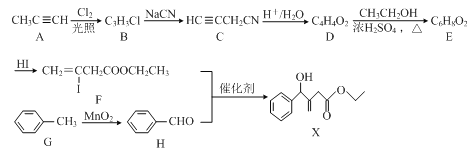
题目内容
【题目】CO2是一种常用的化工原料,经常可以用来转化成高附加值的CO、CH4、CH3OH、CO(NH2)2等一碳(C1)产物。
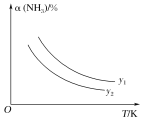
Ⅰ.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)。在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示。该反应的ΔH___(填“>”、“<”或“=”,下同)0,若y表示压强,则y1___y2,若y表示反应开始时的氨碳比[
CO(NH2)2(s)+H2O(g)。在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率的变化情况如图所示。该反应的ΔH___(填“>”、“<”或“=”,下同)0,若y表示压强,则y1___y2,若y表示反应开始时的氨碳比[![]() ],则y1__y2。
],则y1__y2。
Ⅱ.CO2加氢过程,主要发生的三个竞争反应为:
反应i:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) H=-49.01kJmol-1
CH3OH(g)+H2O(g) H=-49.01kJmol-1
反应ii:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) H=-165.0kJmol-1
CH4(g)+2H2O(g) H=-165.0kJmol-1
反应iii:CO2(g)+H2(g)![]() CO(g)+H2O(g) H=+41.17kJmol-1
CO(g)+H2O(g) H=+41.17kJmol-1
回答下列问题:(1)由CO、H2合成甲醇的热化学方程式为__。
(2)如图是某甲醇燃料电池工作的示意图。
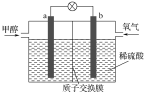
质子交换膜(只有质子能够通过)左右两侧的溶液均为1L2mol·L-1H2SO4溶液。电极a上发生的电极反应为___,当电池中有1mole发生转移时左右两侧溶液的质量之差为___g(假设反应物耗尽,忽略气体的溶解)。
(3)我国科学家研究了不同反应温度对含碳产物组成的影响。在反应器中按![]() =3∶1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
=3∶1通入H2和CO2,分别在0.1MPa和1MPa下进行反应。试验中温度对平衡组成C1(CO2、CO、CH4)中的CO和CH4的影响如图所示(该反应条件下甲醇产量极低,因此忽略“反应i”):
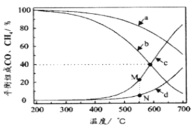
则表示1MPa时CH4和CO平衡组成随温度变化关系的曲线分别是___、___。M点所表示物质的平衡组成高于N点的原因是___。
【答案】< > < CO(g)+2H2(g)![]() CH3OH(g) △H=-90.18kJmol-1 CH3OH-6e-+H2O=CO2↑+6H+ 12 a d 相同温度下,增大压强反应II向正方向移动,c(H2O)增大,使得反应III向逆方向移动,使得CO平衡组分降低
CH3OH(g) △H=-90.18kJmol-1 CH3OH-6e-+H2O=CO2↑+6H+ 12 a d 相同温度下,增大压强反应II向正方向移动,c(H2O)增大,使得反应III向逆方向移动,使得CO平衡组分降低
【解析】
结合温度和压强对平衡的影响分析解答,利用盖斯定律书写热化学反应方程式并计算反应热,根据原电池原理,电极a为负极,电极反应式为CH3OH-6e-+H2O=CO2+6H+,电极b为正极,电极反应式为O2+4H++4e-=2H2O,结合电极反应式进行计算。
Ⅰ.由图象分析可知,温度升高,氨气转化率减小,说明平衡逆向进行,正反应为放热反应,则△H<0,压强越大平衡正向进行,氨气转化率增大,若y表示压强,则一定温度下y1大于y2,若y表示反应开始时的水碳比,升温平衡逆向进行,氨气转化率减小,一定温度下,水和二氧化碳之比越大,平衡逆向进行,氨气转化率越小,则y1小于y2,故答案为:<;>;<;
Ⅱ.(1)反应i-反应iii即可得CO、H2合成甲醇的热化学方程式:CO(g)+2H2(g)![]() CH3OH(g),根据盖斯定律计算焓变:△H=-49.01kJmol-1-41.17kJmol-1=-90.17kJmol-1,故答案为:CO(g)+2H2(g)
CH3OH(g),根据盖斯定律计算焓变:△H=-49.01kJmol-1-41.17kJmol-1=-90.17kJmol-1,故答案为:CO(g)+2H2(g)![]() CH3OH(g) △H=-90.18kJmol-1;
CH3OH(g) △H=-90.18kJmol-1;
(2)由上述分析可知,负极反应式为CH3OH-6e-+H2O=CO2+6H+,当转移1mol电子时,左侧质量减轻![]() ×12g=2g,还要有1mol H+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×
×12g=2g,还要有1mol H+通过质子交换膜进入右侧,质量减少1g,正极反应式为O2+4H++4e-=2H2O,右侧质量增加32g×![]() =8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g,故答案为:CH3OH-6e-+H2O=CO2+6H+;12;
=8g,加上转移过来的1gH+,因此左右两侧溶液的质量之差为8g+1g+2g+1g=12g,故答案为:CH3OH-6e-+H2O=CO2+6H+;12;
(3)对于反应ii,升高温度,平衡逆移,CH4、H2O的百分含量减少,对于平衡iii,升高温度,则平衡正移,CO的百分含量增加;增大压强,反应ii,平衡正移,H2O的百分含量增大,使反应Ⅲ逆移,CO百分含量降低,综上:CH4、CO的变化幅度相对较小,则表示CH4和CO平衡组成随温度变化关系的曲线分别是a、d,故答案为:a;d;相同温度下,增大压强反应II向正方向移动,c(H2O)增大,使得反应III向逆方向动,使得CO平衡组分降低。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
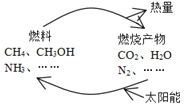
(1)在图构想的物质和能量循环中太阳能最终转化为___能;
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH(甲醇),该反应的化学方程式为:2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
用CH3OH、H2O分别表示0~3min内该反应的平均反应速率为___mol/(L·min)-1、____mol/(L·min)-1;
②能说明该反应已达到平衡状态的是___(填序号);
A.v正(H2O)=2v逆(CO2) B.n(CH3OH)∶n(O2)=2∶3
C.容器内压强保持不变 D.容器内混合气体密度保持不变
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的____极(填“正”或“负”),完成并配平通入氧气一极的电极反应式:___。