题目内容
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
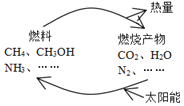
(1)在图构想的物质和能量循环中太阳能最终转化为___能;
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH(甲醇),该反应的化学方程式为:2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g)。
2CH3OH(g)+3O2(g)。
一定条件下,在2L密闭容器中进行上述反应,测得n(CH3OH)随时间的变化如表所示:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
用CH3OH、H2O分别表示0~3min内该反应的平均反应速率为___mol/(L·min)-1、____mol/(L·min)-1;
②能说明该反应已达到平衡状态的是___(填序号);
A.v正(H2O)=2v逆(CO2) B.n(CH3OH)∶n(O2)=2∶3
C.容器内压强保持不变 D.容器内混合气体密度保持不变
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的____极(填“正”或“负”),完成并配平通入氧气一极的电极反应式:___。
【答案】热 0.015 0.03 AC 负 O2+4H++4e-=2H2O
【解析】
(1)根据图示,光合作用下生成燃料,然后燃料燃烧释放出热量;
(2)①根据v=![]() 及速率之比等于化学计量数之比计算反应速率;②根据达到平衡时,正、逆反应速率相等,各物质的浓度、含量不变分析判断;
及速率之比等于化学计量数之比计算反应速率;②根据达到平衡时,正、逆反应速率相等,各物质的浓度、含量不变分析判断;
(3)在燃料电池中,通入燃料的电极是负极、通入氧气的电极是正极,据此分析解答。
(1)由图可知,太阳能首先转化为化学能,其次化学能转化为热能,故答案为:热;
(2)①0~3min内甲醇的物质的量变化0.090mol,则v(CH3OH)= =0.015molL-1min-1,同一反应中化学反应速率与化学计量数成正比,v(H2O)=0.015molL-1min-1×2=0.03molL-1min-1,故答案为:0.015;0.03;
=0.015molL-1min-1,同一反应中化学反应速率与化学计量数成正比,v(H2O)=0.015molL-1min-1×2=0.03molL-1min-1,故答案为:0.015;0.03;
②A.v正(H2O)=2v逆(CO2),表示正、逆反应速率相等,说明反应达到平衡状态,故A正确;B.无论反应是否达到平衡状态,生成物的物质的量之比都等于化学计量数之比,即n(CH3OH)∶n(O2)=2∶3,不能说明反应达到平衡状态,故B错误;C.该反应前后气体的体积不等,容器内气体的压强为变量,压强保持不变,说明反应达到平衡状态,故C正确;D.因气体的体积和质量不变,则容器内密度始终保持不变,不能用于判断是否达到平衡状态,故D错误;故答案为:AC;
(3)用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,反应中甲醇被氧化,通入甲醇的电极为电池的负极,通入氧气的电极为正极,正极发生还原反应,氧气被还原生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:负;O2+4H++4e-=2H2O。

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】I.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学们分别设计了如图甲、乙所示的实验装置。请回答相关问题:

(1)定性甲所示装置可通过观察___,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是___。
(2)定量如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为___,实验中需要测量的数据是___。
Ⅱ.以下是某研究小组探究影响反应速率部分因素的相关实验数据。
实验序号 | H2O2溶液浓度/% | H2O2溶液体积/mL | 温度/℃ | MnO2的用量/g | 收集O2的体积/mL | 反应所需时间/s |
① | 5 | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15 | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30 | 5 | 35 | 2 | 49.21 | |
④ | 30 | 5 | 55 | 2 | 10.76 |
(1)写出实验①中H2O2分解的化学方程式___。
(2)通过实验①和②对比可知,化学反应速率与____有关;从实验③和④对比可知,化学反应速率与温度的关系是___。
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量 (g/100mL )。
I.实验步骤:
(1)用_____ (填仪器名称 )量取10.00mL 食用白醋,在_____ (填仪器名称 )中用水稀释后转移到100mL_____ (填仪器名称 )中定容,摇匀即得待测白醋溶液。
(2)用_____色手柄滴定管取待测白醋溶液 20.00mL 于锥形瓶中,向其中滴加2滴_____作为指示剂。
(3)读取盛装0.1000mol/L NaOH 溶液的滴定管的初始读数。如果液面位置如图所示 则此时的读数为_____mL。
![]()
(4)滴定。当_____时,停止滴定,并记录 NaOH溶液的终读数,重复滴定 3 次。
II.实验记录
滴定次数 实验数据 (mL ) | 1 | 2 | 3 | 4 |
V (样品 ) | 20.00 | 20.00 | 20.00 | 20.00 |
V (NaOH ) (消耗 ) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)甲同学在处理数据时计算得平均消耗的NaOH溶液的体积为:V= (15.95+15.00+15.05+14.95 )/4=15.24(mL)。指出他的计算的不合理之处:_____。 按正确数据处理,可得c (市售白醋)=_____mol/L。
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____ (填写序号)
a.盛装NaOH的滴定管在滴定时未用标准NaOH溶液润洗
b.盛装待测白醋的滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出