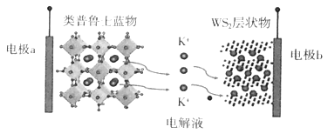
题目内容
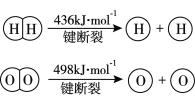
【题目】已知:2H2(g) +O2(g)=2H2O(g) ΔH =-483.6 kJmol-1
下列说法不正确的是
A. 该反应可作为氢氧燃料电池的反应原理
B. 破坏1mol H-O键需要的能量是463.4 kJ
C. H2O(g)=H2(g) +1/2O2(g) ΔH = +241.8 kJmol-1
D. H2(g)中的H-H键比H2O(g)中的H-O键牢固
【答案】D
【解析】
A. 该反应是氧化还原反应,可以用作氢氧燃料电池的原理,A正确;
B. 根据题中的热化学方程式得:ΔH=2EH-H+EO-O-4EH-O,EH-O=![]() =463.4kJ·mol-1,B正确;
=463.4kJ·mol-1,B正确;
C. 根据盖斯定律得:H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8 kJmol-1,C正确;
D. 由题知,H-H键键能为436 kJ·mol-1,H-O键键能为463.4 kJ·mol-1,H-O键 键能更大,所以H-O键更牢固,D错误;
故合理选项为D。

练习册系列答案
相关题目