题目内容
4.Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:| 实验 编号 | HA物质的量 浓度/(mol•L-1) | NaOH物质的量 浓度/(mol•L-1) | 混合后溶 液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中粒子浓度c(A-)和c(Na+)的大小关系C.(填字母)
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+).
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1.
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-、HB-?H++B2-
(5)在0.1mol•L-1的Na2B溶液中,下列粒子浓度关系式正确的是AC.(填字母)
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
分析 (1)等物质的量混合时,二者恰好反应生成盐,根据溶液的pH判断酸性强弱;
(2)任何溶液中都存在电荷守恒,根据电荷守恒判断;
(3)混合溶液的溶质为等物质的量的HA和NaA,pH>7说明A-的水解大于HA的电离,结合电荷守恒判断;
(4)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+);
(5)根据二元酸的电离方程式知,B2-只发生第一步水解,结合电荷守恒和物料守恒分析解答.
解答 解:(1)若HA是强酸,恰好与NaOH溶液反应生成强酸强碱盐,pH=7;若HA是弱酸,生成的NaA水解显碱性,pH>7,
故答案为:a=7时,HA是强酸;a>7时,HA是弱酸;
(2)混合溶液中存在电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),由于pH=7,则c(Na+)=c(A-),
故答案为:C;
(3)混合溶液的溶质为等物质的量的HA和NaA,pH>7说明A-的水解大于HA的电离,所以离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(4)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+)=(10-4-10-10)mol•L-1,
故答案为:10-4-10-10;
(5)在Na2B中存在水解平衡:B2-+H2O=HB-+OH-,HB-不会进一步水解,所以溶液中没有H2B分子,
A.根据物料守恒得c(B2-)+c(HB-)=0.1mol•L-1,故A正确;
B.HB-不会进一步水解,所以溶液中没有H2B分子,故B错误;
C.根据质子守恒得c(OH-)=c(H+)+c(HB-),故C正确;
D.根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-),故D错误;
故答案为:AC.
点评 本题考查了弱电解质的电离、离子浓度大小的比较,题目难度中等,明确弱电解质电离特点结合物料守恒、电荷守恒和质子守恒来分析解答解答,注意(5)中HB-不水解,为易错点.

| A. | 两种溶液中的c(Na+)相等 | |
| B. | 分别加水稀释到100 mL时,两种溶液的pH依然相等 | |
| C. | 两溶液中由水电离出的c(OH-)之比为10-9/10-5 | |
| D. | 分别与同浓度的盐酸反应,pH=7时消耗的盐酸体积相等 |

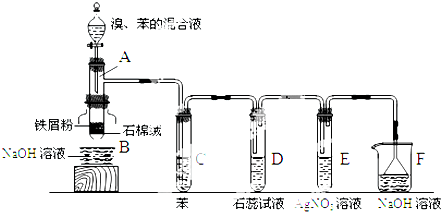
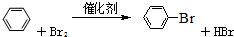 .
.
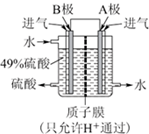 利用原电池原理合成硫酸成为可能,如图利用SO2和O2制备硫酸.其中A、B为多孔材料,可吸附气体.回答下列问题.
利用原电池原理合成硫酸成为可能,如图利用SO2和O2制备硫酸.其中A、B为多孔材料,可吸附气体.回答下列问题.