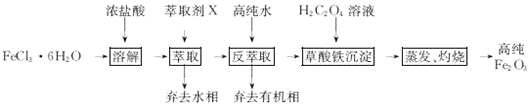
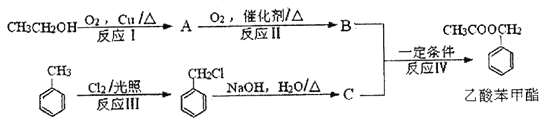
题目内容
【题目】已知:一定温度下的某恒容密闭容器中仅发生反应:2NO2(g) ![]() 2NO(g) + O2(g) △H =+Q kJ/mol (Q>0) 。若向2L该容器中通入1.2 mol NO2 气体,测得100s时反应达到化学平衡状态,此时c(O2) 为0.2 mol/L。下列说法正确的是
2NO(g) + O2(g) △H =+Q kJ/mol (Q>0) 。若向2L该容器中通入1.2 mol NO2 气体,测得100s时反应达到化学平衡状态,此时c(O2) 为0.2 mol/L。下列说法正确的是
A. 增加c(NO),平衡逆向移动,反应的化学平衡常数减小
B. 100s 内NO2的分解速率为8×10-3 mol/(L·s)
C. 反应达平衡时,吸收的热量为0.2Q
D. 其他条件不变时,若开始时n(NO2)为2.4 mol,则达到平衡后,c(O2)<c(NO2)
【答案】D
【解析】A. 增加c(NO),平衡逆向移动,平衡常数只与温度有关与浓度无关,则温度不变,反应的化学平衡常数不变,选项A错误;B、化学反应速率之比等于计量数之比,则100s 内NO2的分解速率等于氧气的生成速率的2倍,为2×![]() =4×10-3 mol/(L·s),选项B错误;C、反应达平衡时生成氧气的物质的量为0.2 mol/L×2L=0.4mol,则吸收的热量为0.4Q,选项C错误;D、开始时n(NO2)为1.2 mol,平衡时c(NO2)=
=4×10-3 mol/(L·s),选项B错误;C、反应达平衡时生成氧气的物质的量为0.2 mol/L×2L=0.4mol,则吸收的热量为0.4Q,选项C错误;D、开始时n(NO2)为1.2 mol,平衡时c(NO2)= ![]() =0.2mol/L,c(O2)=c(NO2),其他条件不变时,若开始时n(NO2)为2.4 mol,则压强增大平衡向气体体积缩小的逆方向移动,则达到平衡后,c(O2)<c(NO2),选项D正确。答案选D。
=0.2mol/L,c(O2)=c(NO2),其他条件不变时,若开始时n(NO2)为2.4 mol,则压强增大平衡向气体体积缩小的逆方向移动,则达到平衡后,c(O2)<c(NO2),选项D正确。答案选D。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】甲苯在一定条件下,可生产二甲苯的混合物和苯。有关物质的沸点、熔点如下:
对二甲苯 | 邻二甲苯 | 间二甲苯 | 苯 | |
沸点/℃ |
|
|
|
|
熔点/℃ |
|
|
|
|
下列说法不正确的是
A. 甲苯生成二甲苯混合物和苯的反应属于取代反应
B. 甲苯的沸点高于![]() ℃
℃
C. 用蒸馏的方法可将苯从反应所得产物中首先分离出来
D. 从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来
【题目】某实验小组欲探究浓硝酸的性质。
Ⅰ.木炭与浓硝酸反应:
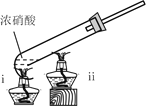
(1)甲同学设计了图1装置,认为若有红棕色气体产生就说明木炭与浓硝酸发生了反应。写出木炭与浓硝酸反应的化学方程式________________________。
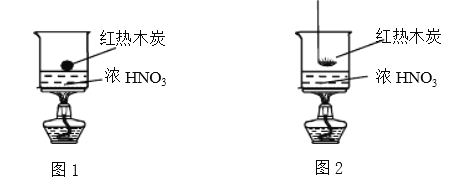
(2)乙同学认为红棕色气体不能作为木炭与浓硝酸反应的证据,其理由是____。
(3)乙同学设计了图2装置实验,木炭能燃烧,并产生红棕色气体。针对该实验现象,乙同学做出如下假设:
假设a:_____________________________;
假设b:红热木炭使HNO3分解产生NO2,NO2可能具有助燃性,木炭燃烧;
假设c:红热木炭使HNO3分解产生O2,木炭与O2反应燃烧;
假设d:红热木炭使HNO3分解产生NO2和O2,共同影响木炭的燃烧;
……
(4)设计实验证明假设b成立,请将实验方案补充完整。
①实验方法:_________________。
实验现象:木炭在该气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
②根据实验现象写出木炭与此气体反应的化学方程式________________。
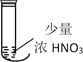
Ⅱ.设计硝酸在不同条件下分解实验,方案见下表:
装置 |
|
|
|
操作 及 现象 | 先点燃ⅰ处酒精灯,溶液沸腾后没有观察到红棕色气体产生。然后撤走ⅰ处酒精灯,点燃ⅱ处酒精灯并加热试管中部,很快看到大量红棕色气体产生 | 光照8小时,溶液不变黄 | 光照几分钟后看到液面上方出现红棕色,溶液变黄 |
(5)分析上述现象,得出使硝酸成功分解的关键是_____________。