题目内容
【题目】下图中的电化学装置以甲醇(CH3OH)为主要原料合成碳酸二甲酯[(CH3O)2CO],相关说法错误的是
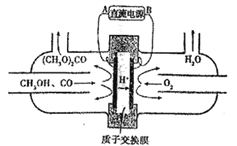
A. B是直流电源的负极
B. 碳酸二甲酯中碳均为+4价
C. 阳极附近溶液pH降低
D. 每当有2molH+通过离子交换膜,消耗氧气的体积在标准状况下为11.2L
【答案】B
【解析】试题分析:由题意知,该装置可以用甲醇、CO和氧气合成碳酸二甲酯,其中氧气是氧化剂发生还原反应。由图中信息可知,甲醇从与A相连的电极通入,氧气从与B相连的电极通入,所以A为正极、B为负极。A. B是直流电源的负极,A正确;B. 碳酸二甲酯中,羰基上的碳显+4价,甲基中的碳为-2价,分子中碳的平均化合价为0,B不正确;C. 阳极的电极反应为2CH3OH+CO-2e- =(CH3O)2CO+2H+,所以阳极附近溶液pH降低,C正确;D. 由前面的分析可知,每当有2molH+通过离子交换膜,电路中就有2mole-通过,所以阴极就消耗0.5mol氧气,0.5mol氧气的体积在标准状况下为11.2L,D正确。本题选B。

 通城学典默写能手系列答案
通城学典默写能手系列答案【题目】二氧化碳的回收利用是环保领域研究的热点课题。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示,其总反应的化学方程式为_________。

(2)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_________。
(3)在2L恒容密闭容器中充入2molCO2和n molH2,在一定条件下发生(2)中的反应,CO2的转化率与温度、投料比[X= ![]() ]的关系如图所示。
]的关系如图所示。

①X1_________X2(填“>”、“<”或“=”,下同),平衡常数KA_________KB.
②若B点的投料比为3,且从反应开始到B点需要10min,则v(H2)=_______ molL-1·min-1。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理图如下图。(丙烯的结构简式:CH3CH=CH2)

①b电极的名称是_________;
②产生丙烯的电极反应式为_______________。