题目内容
【题目】在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
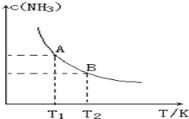
(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0(填“>”或“<”)。
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为_________,N2的转化率___________。
(3)T1温度下该反应的化学平衡常数K1=______________。
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L,在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=)。
【答案】><0.008mol/(L·min)40%18.3否>
【解析】
(1)由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数关系K1>K2,而升高温度平衡向吸热反应移动,故正反应为放热反应,则△H<0;
(2)将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,温度为T1时平衡混合气体中氨气的体积分数为25.0%,则:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始量(mol): 1 3 0
变化量(mol): n 3n 2n
平衡量(mol): 1-n 3-3n 2n
所以![]() ,解得n=0.4。故v(N2)=
,解得n=0.4。故v(N2)=![]() =0.008mol/(L·min),N2的转化率=
=0.008mol/(L·min),N2的转化率=![]() ;
;
(3)根据(2)中分析可知T1温度下该反应的化学平衡常数K1=![]() ;
;
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L,则此时浓度商Qc=![]() ,未处于平衡状态,反应向正反应进行,则v正>v逆。
,未处于平衡状态,反应向正反应进行,则v正>v逆。