题目内容
【题目】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
回答下列问题:
(1)计算CO(g)+2H2(g) ![]() CH3OH(g)的反应热△H4=________________。
CH3OH(g)的反应热△H4=________________。
(2)若在绝热、恒容的密闭容器中充入1 mol CO、2 mol H2,发生CO(g)+2H2(g) ![]() CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
CH3OH(g)反应,下列示意图正确且能说明反应在进行到t1时刻为平衡状态的是________(填选项字母)。
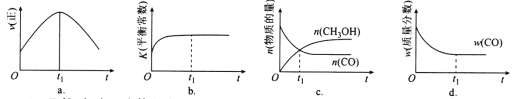
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,则5 min内用H2表示的反应速率为v(H2)=_______________________。T1℃时,在另一体积不变的密闭容器中也充入1 mol CO、2 mol H2,达到平衡时CO的转化率为0.7,则该容器的体积______5 L(填“>”“<”或“=”);T1℃时,CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数K=____________________________。
CH3OH(g)的平衡常数K=____________________________。
(4)为了提高燃料的利用率可以将甲醇设计为燃料电池,写出KOH作电解质溶液时,甲醇燃料电池的负极反应式:_________________________。该电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,这种电化学保护方法叫做___________。
(5)含有甲醇的废水随意排放会造成水污染,可用ClO2将其氧化为CO2,然后再加碱中和即可。写出处理甲醇酸性废水过程中,ClO2与甲醇反应的离子方程式:_________。
【答案】-574.4kJ/mol d 0.064mol/(L·min) > 625 CH3OH-6e-+8OH-=CO32-+6H2O 外加电流的阴极保护法 5CH3OH+6ClO2=6Cl-+5CO2+6H++7H2O
【解析】
(1)结合热化学方程式和盖斯定律计算,①+②×2-③得到CO(g)+2H2(g)![]() CH3OH(g)的热化学方程式,求出焓变;
CH3OH(g)的热化学方程式,求出焓变;
(2)该反应为放热反应,根据平衡状态的特征判断各图象;
(3)结合化学三段式法列式计算,反应速率为v(H2)=△c/△t,气体物质的量之比等于气体体积之比,平衡常数随温度变化,K=生成物平衡浓度幂之乘积/反应物平衡浓度幂之积;
(4)燃料原电池中,燃料失电子发生氧化反应为负极,通入氧气得到电子发生还原反应为正极,电解池中阴极被保护;
(5)根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水。
(1)已知:
①CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ/mol
②H2(g)+1/2O2(g)=H2O(g) △H2=-241.8kJ/mol
③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H3=-192.2kJ/mol
根据盖斯定律计算①+②×2-③得到CO(g)+2H2(g)![]() CH3OH(g)的热化学方程式的△H4=-574.4KJ·mol-1;
CH3OH(g)的热化学方程式的△H4=-574.4KJ·mol-1;
(2)a、在图1中,t1时刻如果达到平衡,正反应速率应不变,而不是随时间间改变而减小,故a错误;
b、充入1molCO、2molH2,生成甲醇放出热量,反应体系的温度升高,K减小,而不是增大,故b错误;
c、t1时刻一氧化碳与甲醇的物质的量相等,但二者物质的量依然在变化,不是平衡状态,故c错误;
d、随着反应的进行,一氧化碳的质量减小,一氧化碳的质量分数不变,说明各物质的质量不变,反应达平衡状态,故d正确;故选d。
(3)T1℃时,在一个体积为5 L的恒容容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.8,根据三段式法有:
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量(mol·L-1) 0.2 0.4 0
变化量(mol·L-1) 0.16 0.32 0.16
平衡量(mol·L-1) 0.04 0.08 0.16
则5min内用H2表示的反应速率为v(H2)=0.32mol·L-1/5min=0.064mol/(L·min);
温度不变,T1℃时,在另一体积不变的密闭容器中也充入1mol CO、2mol H2,达到平衡时CO的转化率为0.7,转化率减小说明平衡左移,体积增大,则该容器的体积大于5 L;
T1℃时,CO(g)+2H2(g)![]() CH3OH(g)的平衡常数K=0.16/(0.04×0.082)=625;
CH3OH(g)的平衡常数K=0.16/(0.04×0.082)=625;
(4)燃料原电池中,甲醇失电子发生氧化反应,通入燃料甲醇的电极为负极,电极反应式为:CH3OH+8OH--6e-═CO32-+6H2O,当电池负极与水库的铁闸相连时,可以保护铁闸不被腐蚀,是利用铁闸做电解池阴极被保护,名称为:外加电流的阴极保护法;
(5)根据信息:二氧化氯和甲醇反应,生成Cl-、CO2和水,根据得失电子守恒和原子守恒,该反应的离子方程式为:6ClO2+5CH3OH=6Cl-+5CO2+6H++7H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)![]() C8H8(g)+H2(g) ΔH=+125kJ·mol-1。某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
C8H8(g)+H2(g) ΔH=+125kJ·mol-1。某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是________。
(2)该温度下,该反应的化学平衡常数是________(保留两位有效数字)。
(3)若保持其他条件不变,用0.40mol H2(g)和0.40mol C8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是________。
【题目】臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)![]() N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,下列选项中有关图象对应的分析正确的是( )
A | B | C | D |
|
|
|
|
平衡后升温,NO2含量降低 | 0~2 s内,v(O3)=0.2 mol·L-1·s-1 | v正:b点>a点 b点:v逆>v正 | 恒温,t1时再充入O3 |
A. AB. BC. CD. D