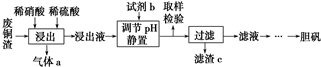
题目内容
2.在 200mL 0.5mol/L H2SO4 溶液中,c(H+)=1mol/L,溶质的质量是9.8g.此溶液中含 n(H+)=0.2mol.分析 溶液中硫酸完全电离,故溶液中c(H+)=2c(H2SO4),再根据m=nM计算H2SO4的质量,根据n=cV计算n(H+).
解答 解:n(H2SO4)=0.2L×0.5mol/L=0.1mol,c(H+)=2c(H2SO4)=2×0.5mol/L=1mol/L,m=nM=0.1mol×98g/mol=9.8 g,n(H+)=0.1mol×2=0.2mol,故答案为:1mol/L; 9.8 g; 0.2mol.
点评 本题考查物质的量浓度计算,比较基础,侧重对基础知识的巩固.

练习册系列答案
相关题目
13.下列叙述不正确的是( )
| A. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其生腐蚀 | |
| B. | 反应SO2(g)+2H2S(g)=3S(S)+2H2O(l)在常温下能自发进行,则该反应的△H<0 | |
| C. | 0.1mol•L-1的CH3COOH溶液加水稀释,溶液的pH和溶液中水的电离程度均增大 | |
| D. | 常温下,将等体积、等物质的量浓度的NaHCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得溶液pH<7,存在KW/c(H+)>1.0×10-7 mol•L-1 |
17.某小组在某温度下测定溶液的pH时发现,0.01mol/L的NaOH溶液中,c(H+)•c(OH-)=10-12(mol/L)2,则该小组在该温度下测得0.1mol/LNaOH溶液和0.1mol/LHCl溶液pH应为( )
| A. | 13、1 | B. | 13、2 | C. | 11、1 | D. | 10、2 |
7.下列实验操作不正确的是( )
| A. |  | B. |  | C. |  | D. |  |
14.下列反应既属于化合反应,又属于氧化还原反应的是( )
| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | CO2+H2O═H2CO3 | ||
| C. | Fe+H2SO4=FeSO4+H2↑ | D. | MgCO3+2HCl═2HCl2+CO2↑+H2O |
12.现有部分短周期元素对应单质的性质或原子结构如表所示:
A、B、D三种单质(分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如下图所示(某些条件已略去).其中丁是一种高能燃料,一个分子含有18个电子,其组成元素与丙相同.

请回答:
(1)元素X在周期表中的位置是第三周期第ⅢA族,其简单离子的结构示意图为 .
.
(2)单质B的电子式 .
.
(3)丙中所含的化学键类型有b(填字母序号).
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:2NH3+NaClO═N2H4+NaCl+H2O.
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.该化学方程式为4Al+3TiO2+3C═2Al2O3+3TiC.
| 元素编号 | 元素性质或原子结构 |
| X | 第三周期元素的简单离子中半径最小 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 原子核外电子数和周期序数相等 |

请回答:
(1)元素X在周期表中的位置是第三周期第ⅢA族,其简单离子的结构示意图为
 .
.(2)单质B的电子式
 .
.(3)丙中所含的化学键类型有b(填字母序号).
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:2NH3+NaClO═N2H4+NaCl+H2O.
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.该化学方程式为4Al+3TiO2+3C═2Al2O3+3TiC.