题目内容
12.现有部分短周期元素对应单质的性质或原子结构如表所示:| 元素编号 | 元素性质或原子结构 |
| X | 第三周期元素的简单离子中半径最小 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 原子核外电子数和周期序数相等 |

请回答:
(1)元素X在周期表中的位置是第三周期第ⅢA族,其简单离子的结构示意图为
 .
.(2)单质B的电子式
 .
.(3)丙中所含的化学键类型有b(填字母序号).
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:2NH3+NaClO═N2H4+NaCl+H2O.
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.该化学方程式为4Al+3TiO2+3C═2Al2O3+3TiC.
分析 X是第三周期元素的简单离子中半径最小,则X为Al,Y最简单氢化物丙的水溶液呈碱性,则Y为N元素,丙为NH3,Z原子核外电子数和周期序数相等,则Z为H元素.A、B、D三种单质分别由X、Y、Z元素组成,则A为Al、B为N2、D为H2,丁是一种高能燃料,其组成元素与丙相同,且含有18mol电子,则丁为N2H4;Al与氮气反应生成甲为AlN,AlN水解得到氨气与氢氧化铝,故戊为Al(OH)3,乙为Al2O3,据此解答.
解答 解:X是第三周期元素的简单离子中半径最小,则X为Al,Y最简单氢化物丙的水溶液呈碱性,则Y为N元素,丙为NH3,Z原子核外电子数和周期序数相等,则Z为H元素.A、B、D三种单质分别由X、Y、Z元素组成,则A为Al、B为N2、D为H2,丁是一种高能燃料,其组成元素与丙相同,且含有18mol电子,则丁为N2H4;Al与氮气反应生成甲为AlN,AlN水解得到氨气与氢氧化铝,故戊为Al(OH)3,乙为Al2O3.
(1)元素X为Al,在周期表中的位置是:第三周期第ⅢA族,其简单离子的结构示意图为 ,
,
故答案为:第三周期第ⅢA族; ;
;
(2)单质B为N2,电子式为 ,故答案为:
,故答案为: ;
;
(3)丙为NH3,N原子与H原子之间形成极性共价键,故选:b;
(4)反应②为氨气与NaClO的反应,0.5molNaClO参加反应时,转移1mol电子,则Cl元素由+1价降低为-1价,该反应生成NaCl,同时生成N2H4和水,则该反应为2NH3+NaClO═N2H4+NaCl+H2O,
故答案为:2NH3+NaClO═N2H4+NaCl+H2O;
(5)一定条件下,Al与TiO2、C(石墨)反应只生成Al2O3和碳化钛(TiC),该化学方程式为:4Al+3TiO2+3C═2Al2O3+3TiC,
故答案为:4Al+3TiO2+3C═2Al2O3+3TiC.
点评 本题考查无机物的推断,侧重于学生的分析推理能力的考查,需要学生熟练掌握元素化合物性质,题目难度中等.

 阅读快车系列答案
阅读快车系列答案(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是BD.
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH-) D.c(OH-)/c(H+)
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将减小(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=4;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.

| A. | 纯铁的腐蚀属于电化学腐蚀 | |
| B. | 钢铁吸氧腐蚀时,负极的电极反应式为Fe-3e-═Fe3﹢ | |
| C. | 海轮在浸水部位镶一些铜锭可起到抗腐蚀作用 | |
| D. | 在图示氧浓差腐蚀中,M极处发生的电极反应为O2+2H2O+4e-═4OH- |
| A. | CH4与P4的分子结构都是正四面体形,因此在6.02×1023个CH4分子或P4分子中都含有4×6.02×1023个共价键 | |
| B. | 在含6.02×1023个硅原子的二氧化硅晶体中含有4×6.02×1023个Si-O键 | |
| C. | 5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去0.2×6.02×1023个电子 | |
| D. | 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子 |
| A. | 第六周期ⅣB族 | B. | 第六周期ⅢB族 | C. | 第六周期0族 | D. | 第六周期ⅢA族 |
| A. | 放电时.将电能转化成化学能 | |
| B. | 充电时,阳极反应为Li++e-═Li | |
| C. | 正极的电极反应式为FeS2+2e-+2Li+═Li2FeS2 | |
| D. | 每转移0.1mol电子,正极材料消耗12.0g |
 与
与 互为同分异构体
互为同分异构体 与
与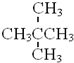 属于同系物
属于同系物 与
与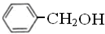 既不是同系物也不是同分异构体.
既不是同系物也不是同分异构体. .
.