��Ŀ����
��������ͭ��һ����� 10mol?L-1��Ũ�����ַ�Ӧ���õ�Cu��NO3��2��Һ��NO2��NO������壬������������������������ˮ�У�ͨ��2.24L O2����״����������������ȫ��ˮ�����������ᣮ������ӦΪ��4NO2+O2+2H2O=4HNO3��4NO+3O2+2H2O=4HNO3����������Cu��NO3��2��Һ�м���5mol?L-1NaOH��ҺʹCu2+ǡ����ȫ������������NaOH��Һ�������
- A.40 mL
- B.60 mL
- C.80 mL
- D.100 mL
C
����������������HNO3 ��Ӧǰ��û�б仯����Cuʧȥ�ĵ��Ӷ���O2�õ��ˣ����ݵ��ӵ�ʧ�غ㣬����μӷ�Ӧ��ͭ��Ȼ����� Cu��NO3��2���ٸ��� Cu��NO3��2��NaOH ��Ӧ�Ĺ�ϵ�����NaOH�����ʵ�������������NaOH��Һ�������
�����ȫ����HNO3��������������HNO3 ��Ӧǰ��û�б仯����Cuʧȥ�ĵ��Ӷ���O2�õ��ˣ�
���ݵ�ʧ�����غ㣺n��Cu����2=n��O2����4����n��Cu����2=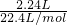 mol��4��
mol��4��
���n��Cu��=0.2mol������Cu��NO3��2 =0.2mol����
Cu2+��2OH-
1 2
0.2mol n��OH-��
����n��OH-��=0.2mol��2=0.4mol
��ҪNaOH��Һ�����Ϊ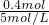 =0.08L=80mL��
=0.08L=80mL��
��ѡC��
���������⿼��������㡢������ԭ��Ӧ����ȣ��ѶȽϴ����ó��淽��������غ�˼���ڻ�ϼ���������ã��жϽ���ʧȥ�ĵ��ӵ���������õĵ����ǹؼ���
����������������HNO3 ��Ӧǰ��û�б仯����Cuʧȥ�ĵ��Ӷ���O2�õ��ˣ����ݵ��ӵ�ʧ�غ㣬����μӷ�Ӧ��ͭ��Ȼ����� Cu��NO3��2���ٸ��� Cu��NO3��2��NaOH ��Ӧ�Ĺ�ϵ�����NaOH�����ʵ�������������NaOH��Һ�������
�����ȫ����HNO3��������������HNO3 ��Ӧǰ��û�б仯����Cuʧȥ�ĵ��Ӷ���O2�õ��ˣ�
���ݵ�ʧ�����غ㣺n��Cu����2=n��O2����4����n��Cu����2=
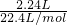 mol��4��
mol��4�����n��Cu��=0.2mol������Cu��NO3��2 =0.2mol����
Cu2+��2OH-
1 2
0.2mol n��OH-��
����n��OH-��=0.2mol��2=0.4mol
��ҪNaOH��Һ�����Ϊ
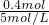 =0.08L=80mL��
=0.08L=80mL����ѡC��
���������⿼��������㡢������ԭ��Ӧ����ȣ��ѶȽϴ����ó��淽��������غ�˼���ڻ�ϼ���������ã��жϽ���ʧȥ�ĵ��ӵ���������õĵ����ǹؼ���

��ϰ��ϵ�д�
�����Ŀ
����˵������ȷ���ǣ�������
| A����0.1mol CuSO4?5H2O������뵽100 mLˮ�У�����Һ���ʵ���Ũ��Ϊ1 mol?L-1 | ||
| B��һ�������Ũ���ᣨ���к�0.2mol H2SO4����������ͭ���ȷ�Ӧ������SO2����0.1mol | ||
| C����34.2 g Al2��SO4��3����ˮ���100 mL��Һ[Al2��SO4��3���������Ϊ342J��ȡ��10 mL����Һ��Al3+Ũ��Ϊ1 mol?L-1 | ||
D��KCl��Һ���ܶ�Ϊ1.174 g?cm-3�����ʵ���Ũ��Ϊ4.0 mol?L-1�������Һ��KCl����������Ϊ
|