题目内容
下列各组数据中,其比值为2:1的是( )
分析:A.根据电荷守恒判断;
B.相同温度下,同一弱电解质的不同浓度的溶液中,浓度越大,其电离程度越小;
C.碳酸根离子水解,钠离子不水解;
D.氢氧化钾和氢氧化钡都是强电解质,在水溶液里完全电离,根据溶液的pH金属氢氧根离子浓度,根据氢氧根离子和碱的关系式计算碱的浓度.
B.相同温度下,同一弱电解质的不同浓度的溶液中,浓度越大,其电离程度越小;
C.碳酸根离子水解,钠离子不水解;
D.氢氧化钾和氢氧化钡都是强电解质,在水溶液里完全电离,根据溶液的pH金属氢氧根离子浓度,根据氢氧根离子和碱的关系式计算碱的浓度.
解答:解:A.根据电荷守恒得c(NH4+)+c(H+)=c(OH-)+2c(SO42- ),溶液呈中性,则c(H+)=c(OH-),则c(NH4+)=2c(SO42- ),故A正确;
B.相同温度下,同一弱电解质的不同浓度的溶液中,浓度越大,其电离程度越小,所以相同温度下,0.2 mol?L-1HCOOH溶液与0.1 mol?L-1HCOOH溶液中c(H+)之比<2:1,故B错误;
C.碳酸钠是强碱弱酸盐,碳酸根离子易水解,钠离子不水解,所以c(Na+)与c(CO32-)之比大于2:1,故C错误;
D.氢氧化钾和氢氧化钡都是强电解质,在水溶液里完全电离,pH=12的KOH溶液与pH=12的Ba(OH)2溶液中氢氧根离子浓度相等,根据其化学式知,二者之间的物质的量浓度之比2:1,故D正确;
故选AD.
B.相同温度下,同一弱电解质的不同浓度的溶液中,浓度越大,其电离程度越小,所以相同温度下,0.2 mol?L-1HCOOH溶液与0.1 mol?L-1HCOOH溶液中c(H+)之比<2:1,故B错误;
C.碳酸钠是强碱弱酸盐,碳酸根离子易水解,钠离子不水解,所以c(Na+)与c(CO32-)之比大于2:1,故C错误;
D.氢氧化钾和氢氧化钡都是强电解质,在水溶液里完全电离,pH=12的KOH溶液与pH=12的Ba(OH)2溶液中氢氧根离子浓度相等,根据其化学式知,二者之间的物质的量浓度之比2:1,故D正确;
故选AD.
点评:本题考查了弱电解质的电离,易错选项是B,注意同温下,同一弱电解质溶液中溶液浓度与弱电解质电离程度的关系,为易错点.

练习册系列答案
相关题目
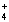 ) 与c(SO
) 与c(SO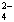 ) 之比
) 之比