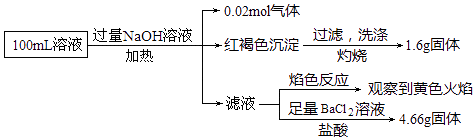
题目内容
【题目】一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2 (g)+2H2O(g)△H1=﹣574kJmol﹣1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=﹣1160kJmol﹣1
下列选项正确的是( )
A.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867kJmol﹣1
B.CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)的反应热为△H3 , 则△H3>△H1
C.若用0.2molCH4还原NO2至N2 , 则反应中放出的热量一定为173.4kJ
D.若用标准状况下2.24LCH4还原NO2至N2 , 整个过程中转移的电子为1.6mol
【答案】A
【解析】解:A、反应①+②可得到2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O( g ),△H=(﹣574kJmol﹣1)+(﹣1160kJmol﹣1)=﹣1734kJmol﹣1 , 则CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O( g )△H= ![]() =﹣867kJmol﹣1 , 故A正确;B、液态水变为气态水时要吸收热量,焓变是带有符号的,如果CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)的反应热为△H3 , 则△H3<△H1 , 故B错误;
=﹣867kJmol﹣1 , 故A正确;B、液态水变为气态水时要吸收热量,焓变是带有符号的,如果CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l)的反应热为△H3 , 则△H3<△H1 , 故B错误;
C、由反应CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O( g )△H=﹣867kJmol﹣1 , 可得:放出的热量为0.2mol×867kJmol﹣1=173.4kJ,但是反应热和物质的状态有关,所以反应中放出的热量不一定为173.4kJ,故C错误;
D、甲烷的物质的量为 ![]() =0.1mol,碳元素的化合价由﹣4价升高为+4价,则转移的电子总数为为0.1mol×8=0.8mol,故D错误;
=0.1mol,碳元素的化合价由﹣4价升高为+4价,则转移的电子总数为为0.1mol×8=0.8mol,故D错误;
故选A.

 名题金卷系列答案
名题金卷系列答案