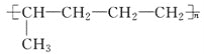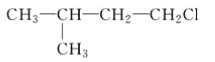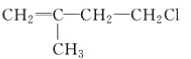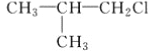题目内容
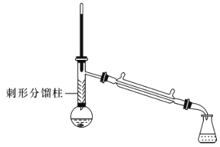
【题目】有“退热冰”之称的乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,纯乙酰苯胺是一种白色有光泽片状结晶,不仅本身是重要的药物,而且是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体。实验室用苯胺与乙酸合成乙酰苯胺的反应和实验装置如图(夹持及加热装置略):
![]() +CH3COOH
+CH3COOH +H2O
+H2O
注:①苯胺与乙酸的反应速率较慢,且反应是可逆的。
②苯胺易氧化,加入少量锌粉,防止苯胺在反应过程中氧化。
③刺形分馏柱的作用相当于二次蒸馏,用于沸点差别不太大的混合物的分离。
可能用到的有关性质如下:(密度单位为g/cm3)
名称 | 相对分子质量 | 性状 | 密度/gcm3 | 熔点/℃ | 沸点/ | 溶解度 | |
g/100g水 | g/100g乙醇 | ||||||
苯胺 | 93.12 | 棕黄色油状液体 | 1.02 | -6.3 | 184 | 微溶 | ∞ |
冰醋酸 | 60.052 | 无色透明液体 | 1.05 | 16.6 | 117.9 | ∞ | ∞ |
乙酰苯胺 | 135.16 | 无色片状晶体 | 1.21 | 155~156 | 280~290 | 温度高,溶解度大 | 较水中大 |
合成步骤:
在50mL圆底烧瓶中加入10mL新蒸馏过的苯胺和15mL冰乙酸(过量)及少许锌粉(约0.1g)。用刺形分馏柱组装好分馏装置,小火加热10min后再升高加热温度,使蒸气温度在一定范围内浮动1小时。在搅拌下趁热快速将反应物以细流倒入100mL冷水中冷却。待乙酰苯胺晶体完全析出时,用布氏漏斗抽气过滤,洗涤,以除去残留酸液,抽干,即得粗乙酰苯胺。
分离提纯:
将粗乙酰苯胺溶于300mL热水中,加热至沸腾。放置数分钟后,加入约0.5g粉未状活性炭,用玻璃棒搅拌并煮沸10min,然后进行热过滤,结晶,抽滤,晾干,称量并计算产率。
(1)由于冰醋酸具有强烈刺激性,实验中要在__内取用,加入过量冰醋酸的目的是__。
(2)反应开始时要小火加热10min是为了__。
(3)实验中使用刺形分馏柱能较好地提高乙酰苯胺产率,试从化学平衡的角度分析其原因:__。
(4)反应中加热方式可采用__(填“水浴”“油浴”或"直接加热”),蒸气温度的最佳范围是__(填字母代号)。
a.100~105℃ b.117.9~184℃ c.280~290℃
(5)判断反应基本完全的现象是__,洗涤乙酰苯胺粗品最合适的试剂是__(填字母代号)。
a.用少量热水洗 b.用少量冷水洗
c.先用冷水洗,再用热水洗 d.用酒精洗
(6)分离提纯乙酰苯胺时,在加入活性炭脱色前需放置数分钟,使热溶液稍冷却,其目的是__,若加入过多的活性炭,使乙酰苯胺的产率__(填“偏大”“偏小”或“无影响”)。
(7)该实验最终得到纯品7.36g,则乙酰苯胺的产率是__%(结果保留一位小数)。
【答案】通风橱 促进反应正向进行,提高苯胺的转化率 让苯胺与乙酸反应成盐 使用刺形分馏柱可以很好地将沸点差别不太大的乙酸和水分开,只将生成的水蒸出,使平衡向生成乙酸苯胺的方向移动,乙酸又可以回流到烧瓶内继续反应,从而提高乙酰苯胺的产率 油浴 a 冷凝管中不再有液滴流下 b 防止暴沸 偏小 49.7
【解析】
(1)由于冰醋酸具有强烈刺激性,实验中要防止其扩散到室内空气中,过量加入反应物(冰醋酸)的目的,应从平衡移动考虑。
(2)反应开始时要小火加热10min,主要是让反应物充分反应。
(3)实验中使用刺形分馏柱,可提高乙酰苯胺产率,则应从反应物的利用率和平衡移动两个方面分析原因。
(4)反应中加热温度超过100℃,不能采用水浴;蒸发时,应减少反应物的挥发损失。
(5)判断反应基本完全,则基本上看不到反应物产生的现象;乙酰苯胺易溶于酒精,在热水中的溶解度也比较大,由此可确定洗涤粗品最合适的试剂。
(6)热溶液中加入冷物体,会发生暴沸;活性炭有吸附能力,会吸附有机物。
(7)计算乙酰苯胺的产率时,应先算出理论产量。
(1)由于冰醋酸具有强烈刺激性,易扩散到室内空气中,损害人的呼吸道,所以实验中要在通风橱内取用;苯胺与冰醋酸的反应为可逆反应,加入过量冰醋酸的目的,促进平衡正向移动,提高苯胺的转化率。答案为:通风橱;促进反应正向进行,提高苯胺的转化率;
(2)可逆反应进行比较缓慢,需要一定的时间,且乙酸与苯胺反应是先生成盐,后发生脱水反应,所以反应开始时小火加热10min,是为了让苯胺与乙酸反应成盐。答案为:让苯胺与乙酸反应成盐;
(3)反应可逆,且加热过程中反应物会转化为蒸气,随水蒸气一起蒸出,实验中使用刺形分馏柱,可将乙酸、苯胺的蒸气冷凝,让其重新流回反应装置内,同时将产物中的水蒸出,从而提高乙酰苯胺的产率,从化学平衡的角度分析其原因是:使用刺形分馏柱可以很好地将沸点差别不太大的乙酸和水分开,只将生成的水蒸出,使平衡向生成乙酸苯胺的方向移动,乙酸又可以回流到烧瓶内继续反应,从而提高乙酰苯胺的产率。答案为:使用刺形分馏柱可以很好地将沸点差别不太大的乙酸和水分开,只将生成的水蒸出,使平衡向生成乙酸苯胺的方向移动,乙酸又可以回流到烧瓶内继续反应,从而提高乙酰苯胺的产率;
(4)反应中需要将生成的水蒸出,促进平衡正向移动,提高产率。水的沸点是100℃,而冰醋酸的沸点为117.9℃,温度过高会导致反应物的挥发,温度过低反应速率太慢,且不易除去水,所以加热温度应介于水与乙酸的沸点之间,不能采用水浴反应,加热方式可采用油浴,最佳温度范围是a。答案为:油浴;a;
(5)不断分离出生成的水,可以使反应正向进行,提高乙酰苯胺的产率,反应基本完全时,冷凝管中不再有液滴流下;乙酰苯胺易溶于酒精和热水,所以洗涤粗品最合适的试剂是用少量的冷水洗,以减少溶解损失。答案为:冷凝管中不再有液滴流下;b;
(6)分离提纯乙酰苯胺时,若趁热加入活性炭,溶液会因受热不均而暴沸,所以在加入活性炭脱色前需放置数分钟,使热溶液稍冷却,其目的是防止暴沸,若加入过多的活性炭,则会吸附一部分乙酰苯胺,使乙酰苯胺的产率偏小。答案为:防止暴沸;偏小;
(7)苯胺的物质的量为![]() =0.11mol,理论上完全反应生成乙酰苯胺的质量为0.11mol×135.16g/mol=14.8g,该实验最终得到纯品7.36g,则乙酰苯胺的产率是
=0.11mol,理论上完全反应生成乙酰苯胺的质量为0.11mol×135.16g/mol=14.8g,该实验最终得到纯品7.36g,则乙酰苯胺的产率是![]() =49.7%。答案为:49.7。
=49.7%。答案为:49.7。

【题目】根据下列实验操作和现象能得出相应结论的是
选项 | 实验操作 | 现象 | 结论 |
A | 将 | 溶液红色褪去 |
|
B | 分别向盛有 | a中溶液变蓝,b中产生黄色沉淀 |
|
C | 向淀粉溶液中加入稀硫酸并加热,再加入银氨溶液,水浴加热 | 未见有银镜产生 | 淀粉没有水解 |
D | 向无水乙醇中加入浓硫酸,加热,产生的气体通入酸性 | 溶液紫色褪去 | 气体中含有乙烯 |
A.AB.BC.CD.D
【题目】(1)已知下表数据:
化学式 | 电离平衡常数(25℃) |
HCN | K=5.0×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7 ,K2=4.7×10-11 |
① 25℃时,等浓度的四种溶液:a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液 d.NaHCO3溶液,pH由大到小的顺序为_______(填序号)。
② 将0.2mol/LHCN溶液和0.1mol/L的NaOH溶液等体积混合后,溶液显碱性,则c(HCN)、c(H+)、c(OH-)、c(CN-)、c(Na+)浓度排序为_______,c(HCN)+c(CN-)_____(填“>”、“<”或“=”)0.1mol/L。
③ 相同条件下,取等体积等pH的a.HCN溶液 b. CH3COOH溶液 c.H2CO3溶液,各稀释100 倍,稀释后的溶液,其pH大小关系为_______(填序号)。
④ 25℃时,将体积为Va,pH = 13的某一元强碱与体积为Vb,pH=2的某二元强酸混合,若所得溶液的pH=11,则Va:Vb=________。
(2)温度为T℃时水的离子积常数为Kw,该温度下,将浓度为amol/L的H2SO4与bmol/L的一元碱AOH等体积混合。则可判断溶液呈中性的是_______(填序号)。
①混合溶液的pH=7 ②c(SO42-)=![]() c(A+)
c(A+)
③混合溶液中c(H+)c(OH-)=Kw ④ 混合溶液中c(OH-)=![]()