题目内容
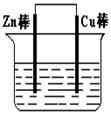
将镁片、铝片平行插入到一定浓度的NaOH溶液中,用导线连接成闭合回路,如图所示,该装置在工作时,下列叙述正确的是( )


| A.镁比铝活泼,因此镁电极作电源负极 |
| B.铝是电池负极,其电极反应式为Al-3e- +3OH-=Al(OH)3 |
| C.该装置的内、外电路中,均是电子的定向移动形成电流 |
| D.该装置开始工作时,铝片表面的氧化膜不必处理 |
D
一般情况下,在原电池中较活泼的金属作负极不活泼的金属作正极。在该原电池中电解质是氢氧化钠溶液,由于镁和氢氧化钠不反应,铝可以和氢氧化钠反应生成氢气,所以此时铝是负极,失去电子,电极反应式为Al-3e- +4OH-=AlO2-+2H2O。镁是正极,电极反应式为6H20+6e-=6OH-+3H2↑。在原电池的电解质溶液中没有电子通过,而是离子的定向运动。由于铝表面的氧化膜三氧化二铝能溶于氢氧化钠溶液中,所以选项D是正确的。答案选D。

练习册系列答案
相关题目