题目内容
(I)将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题:
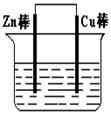
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的 极,可观察到Cu棒上产生现象是 ,试用电极反应式表示该现象: 。
(2)若电解质为硫酸铜溶液,则Cu棒上发生 反应(填“氧化”“还原”),Zn棒上发生反应的电极反应式为: 。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为: 。
(II)A、B、C三个烧杯中分别盛有500mL相同物质的量浓度的稀硫酸
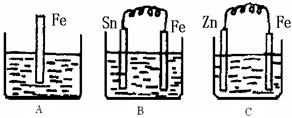
(1)写出A中离子反应方程式:
(2)一段时间后,B中Sn极附近溶液的pH (填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了5.6L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为
(4)反应完成后三个烧杯中液体质量大小顺序为:A B C (用<、=、>连接)。

(1)若电解质溶液为稀硫酸,则Zn棒为原电池的 极,可观察到Cu棒上产生现象是 ,试用电极反应式表示该现象: 。
(2)若电解质为硫酸铜溶液,则Cu棒上发生 反应(填“氧化”“还原”),Zn棒上发生反应的电极反应式为: 。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为: 。
(II)A、B、C三个烧杯中分别盛有500mL相同物质的量浓度的稀硫酸

(1)写出A中离子反应方程式:
(2)一段时间后,B中Sn极附近溶液的pH (填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了5.6L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为
(4)反应完成后三个烧杯中液体质量大小顺序为:A B C (用<、=、>连接)。
(I)(1)负极(1分)有无色气泡析出(1分) 2H++2e-=H2↑(2分)
(2)还原(1分) Zn-2e-=Zn2+(2分)
(3)1:32(2分)
(II)(1)Fe+2H+=Fe2++H2↑ (2分)
(2)增大 (1分)
(3)0.5mol·L-1(2分)
(4)=、<(每空1分)
(2)还原(1分) Zn-2e-=Zn2+(2分)
(3)1:32(2分)
(II)(1)Fe+2H+=Fe2++H2↑ (2分)
(2)增大 (1分)
(3)0.5mol·L-1(2分)
(4)=、<(每空1分)
(I)(1)Zn+CuSO4=ZnSO4+Cu↑
负极:Zn-2e-=Zn2+ 正极:2H++2e-=H2↑
(2)Zn+H2SO4=ZnSO4+H2↑
负极:Zn-2e-=Zn2+ 正极:Cu2++2e-=Cu↑
(3)H2 ~ Zn ~ Cu可知。
(II)B中铁为负极,Sn为正极,2H++2e-=H2↑, pH增大。
C中锌为负极:Zn+H2SO4=ZnSO4+H2↑可求得:
0.25mol 5.6L
c(H2SO4)=0.5mol·L-1
(4)A、B中均发生反应:Fe+H2SO4=FeSO4+H2↑;C中为::Zn+H2SO4=ZnSO4+H2↑
比较可知:A、B硫酸中增加1molFe,析出1molH2,质量增加54g;而C中硫酸中增加1molZn,析出1molH2,质量增加63g;
负极:Zn-2e-=Zn2+ 正极:2H++2e-=H2↑
(2)Zn+H2SO4=ZnSO4+H2↑
负极:Zn-2e-=Zn2+ 正极:Cu2++2e-=Cu↑
(3)H2 ~ Zn ~ Cu可知。
(II)B中铁为负极,Sn为正极,2H++2e-=H2↑, pH增大。
C中锌为负极:Zn+H2SO4=ZnSO4+H2↑可求得:
0.25mol 5.6L
c(H2SO4)=0.5mol·L-1
(4)A、B中均发生反应:Fe+H2SO4=FeSO4+H2↑;C中为::Zn+H2SO4=ZnSO4+H2↑
比较可知:A、B硫酸中增加1molFe,析出1molH2,质量增加54g;而C中硫酸中增加1molZn,析出1molH2,质量增加63g;

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目






