题目内容
【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g) + 3H2(g) ![]() 2NH3(g) △H<0,△S <0。
2NH3(g) △H<0,△S <0。
(1)下列关于工业合成氨的说法不正确的是_______
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂加快反应速率是因为催化剂降低了反应的△H
(2)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的是_______
a 容器内N2、H2、NH3的浓度之比为1:3:2 b v(N2)正= v(H2)逆
c 容器内压强保持不变 d 合气体的密度保持不变
(3)工业上合成氨的部分工艺流程如下:
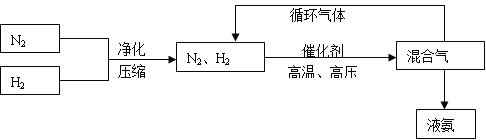
请用平衡移动原理来解释在流程中及时分离出氨气和循环使用气体的原因_______。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。
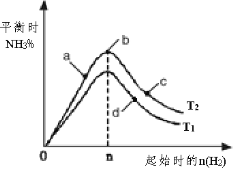
①图象中T2和T1的关系是:T2 __________T1(填“>,<或=”,下同)
②a、b、c、d四点所处的平衡状态中,反应物N2 的转化率最高的是______(填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2mol H2和2mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
①此条件下该反应的化学平衡常数K=___________。
②若维持容器体积不变,温度不变,往原平衡体系中加入H2、N2和NH3各4mol,化学平衡将向_______反应方向移动(填“正”或“逆”)。
③N2(g)+3H2(g) ![]() 2NH3(g) △H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的span>H2的物质的量为______mol。
2NH3(g) △H= -92kJ/mol。在恒温恒容的密闭容器中充入1mol N2和一定量的H2发生反应。达到平衡后,测得反应放出的热量为18.4 kJ,混合气体的物质的量为3.6 mol,容器内的压强变为原来的90%,则起始时充入的span>H2的物质的量为______mol。
(6)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H= -92kJ/mol
2NH3(g) △H= -92kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol
2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol
写出氨气催化氧化生成NO和水蒸气的热化学方程式_________。
【答案】ABCD bc 减少生成物浓度,同时增加反应物浓度,可以使平衡正向进行程度更大,提高产率 < c 0.1 逆 3 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906 kJ·mol-1
【解析】
(1)根据△G=△H-T△S来判断。
(2)a.容器内N2、H2、NH3 浓度比与起始浓度及转化率有关,平衡时不一定等于化学计量数之比。
b.平衡时不同物质表示的正逆速率之比等于化学计量数之比,3v(N2)正= v(H2)逆时反应达到平衡状态。
c.随反应进行,混合气体物质的量变化,容器内压强发生变化,压强保持不变说明到达平衡。
d.混合气体总质量不变,容器容积不变,混合气体密度始终保持不变。
(3)在流程中及时分离出氨气和循环使用气体的原因是减少生成物浓度,同时增加反应物浓度,可以使平衡正向进行程度更大,提高产率。
(4)①由图可知,n(H2)相同时, T2对应氨气含高,反应为放热反应,降低温度有利于生成氨气,则T2<T1。
②a、b、c、d四点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大,c点时氢气的物质的量最大,c点N2的转化率最高。
(5)①根据三段式求解。
②根据QC和K的相对大小进行判断。
③恒温恒容条件下,气体的压强之比等于其物质的量之比,反应达到平衡后,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%,则反应前混合气体的物质的量为4mol,为氢气和氮气的物质的量之和,氮气的物质的量为1mol,则氢气的物质的量为3mol。
(6)根据盖斯定律求得。
(1)A.根据△G=△H-T△S来计算,把△H<0,△S <0代入表达式,该反应可能自发进行,故A错误;
B.根据△G=△H-T△S来计算,把△H<0,△S <0代入表达式,该反应可能自发进行,故B错误;
C.N2(g) + 3H2(g) ![]() 2NH3(g) △H<0,升温平衡逆向移动,故不能提高反应物的转化率,故C错误;
2NH3(g) △H<0,升温平衡逆向移动,故不能提高反应物的转化率,故C错误;
D.使用催化剂加快反应速率是因为催化剂降低了反应的活化能,故D错误;
故选ABCD。
(2)a.容器内N2、H2、NH3 浓度比与起始浓度及转化率有关,平衡时不一定等于化学计量数之比,故a错误;
b.平衡时不同物质表示的正逆速率之比等于化学计量数之比,3v(N2)正= v(H2)逆时反应达到平衡状态,故b正确;
c.随反应进行,混合气体物质的量变化,容器内压强发生变化,压强保持不变说明到达平衡,故c正确;
d.混合气体总质量不变,容器容积不变,混合气体密度始终保持不变,故d错误;
故选bc。
(3)在流程中及时分离出氨气和循环使用气体的原因是减少生成物浓度,同时增加反应物浓度,可以使平衡正向进行程度更大,提高产率,故答案为:减少生成物浓度,同时增加反应物浓度,可以使平衡正向进行程度更大,提高产率。
(4)①由图可知,n(H2)相同时, T2对应氨气含高,反应为放热反应,降低温度有利于生成氨气,则T2<T1,故答案为:<;
②a、b、c、d四点,n(H2)越大,平衡正向移动的程度越大,N2的转化率越大,c点时氢气的物质的量最大,c点N2的转化率最高,此时氢气起始量最大达到平衡状态下H2的百分含量最高,故答案为:c。
(5)①由表中数据可知,20min达到平衡,平衡时NH3的浓度为0.2mol/L,则:
N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
开始(mol/L)0.5 1.3 0
变化(mol/L)0.1 0.3 0.2
平衡(mol/L)0.4 1 0.2
故化学平衡常数K=c2(NH3)/c(N2)c3(H2)=0.22/0.4×13=0.1,故答案为:0.1。
②反应达到平衡后,若维持容器体积不变,温度不变,往平衡体系中加入H2、N2和NH3各4mol,则此时各物质的浓度为:H2为1mol/L+4mol÷4L=2mol/L,N2为0.4mol/L+4mol÷4L=1.4 mol/L,NH3为0.2mol/L+4mol÷4L=1.2mol/L,故浓度商QC=1.22/1.4×23>0.1,故反应向逆反应进行,故答案为:逆。
③恒温恒容条件下,气体的压强之比等于其物质的量之比,反应达到平衡后,混合气体的物质的量为3.6mol,容器内的压强变为原来的90%,则反应前混合气体的物质的量为4mol,为氢气和氮气的物质的量之和,氮气的物质的量为1mol,则氢气的物质的量为3mol,故答案为:3。
(6)N2(g)+3H2(g) ![]() 2NH3(g)△H= -92kJ/mol ①
2NH3(g)△H= -92kJ/mol ①
N2(g)+O2(g)=2NO(g) ΔH= +181kJ/mol ②
2H2(g)+O2(g)=2H2O(g) ΔH= -484kJ/mol ③
氨的催化氧化的化学方程式为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g),该反应可通过③×3+②×2-①×2获得,根据盖斯定律可得△H=-906 kJ/mol;故氨气催化氧化生成NO和水蒸气的热化学方程式为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906 kJ·mol-1,故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH =-906 kJ·mol-1。

【题目】某同学欲探究FeCl3溶液与NaHSO3溶液的反应,设计、完成实验并记录如下:
装置 | 反应时间 | 实验现象 |
| 0~1 min | 产生红褐色沉淀Fe(OH)3,有刺激性气味气体SO2逸出 |
1~30 min | 沉淀迅速溶解形成红色溶液,随后溶液逐渐变为橙色,之后几乎无色 | |
30 min后 | 与空气接触部分的上层溶液又变为浅红色,随后逐渐变为浅橙色 |
已知: Fe(OH)3+SO32-![]()
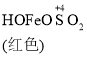
![]()
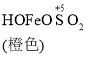
![]() Fe2++SO42-
Fe2++SO42-
下列有关反应速率和化学平衡说法不正确的是
A. 生成红色配合物的反应速率较快,红色配合物生成橙色配合物的速率较慢
B. 增大溶液中SO32-浓度可以加速红褐色沉淀Fe(OH)3迅速溶解
C. O2的作用下,橙色HOFeOSO2浓度下降,平衡![]() 不断正向移动
不断正向移动
D. 30min时,若向该无色溶液中滴加少量FeCl3溶液,无明显现象
【题目】常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08mg/m3。某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其他还原性气体):
(1)测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸,反应的离子方程式为:
4MnO4-+ 5HCHO + 12H+ == 4Mn2+ + 5CO2↑+ 11H2O
2MnO4-+ 5H2C2O4 + 6H+ == 2Mn2++10CO2↑+ 8H2O
(2)测定装置:部分装置如图所示(a、b为止水夹)

(3)实验步骤:
① 检查装置气密性(气密性良好)。
② 用___________(填仪器名称)准确移取20.00 mL 2.00×10-3mol·L—1的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6mol·L-1的H2SO4溶液备用。
③ 将2.00×10-3mol·L-1的草酸标准溶液置于_____________(填仪器名称)中备用。
④ 打开a,关闭b,用注射器抽取100mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?___________。
⑤ 将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将_________(填“偏高”、“偏低”、“无影响”);
⑥ 用标准草酸溶液滴定锥形瓶中的溶液;记录滴定所消耗的草酸溶液体积。本实验是否需要指示剂?_________(填“是或否”),滴定终点时的实验现象为____________________。
⑦ 再重复实验2次。
(4)数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为 20.00mL):
装修后 第n天 | 草酸溶液(mL) | 甲醛的浓度 mg/m3 | |||
1 | 2 | 3 | 平均值 | ||
1 | 15.86 | 15.72 | 15.67 | 15.75 | |
7 | 26.17 | 26.36 | 26.38 | 26.27 | |
30 | 49.05 | 48.98 | 49.02 | 48.95 | |
设 KMnO4溶液的物质的量浓度为c1,KMnO4溶液的体积为v1(mL),草酸溶液的物质的量浓度为c2,草酸溶液的平均体积为v2(mL)则:计算室内空气中甲醛浓度(mg/m3)的代数式为__________(用c1、c2 、v1、v2表示),利用表中数据计算第30天室内空气中甲醛浓度为_______mg/m3。