题目内容
【题目】工业生产的纯碱常含有少量的氯化钠杂质。如图是测定产品中碳酸钠质量分数的实验装置,下列说法不正确的是( )
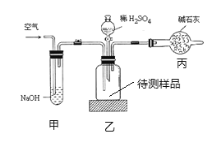
A.装置乙中发生的反应方程式为H2SO4+Na2CO3=Na2SO4+CO2↑+H2O
B.装置甲的作用是除去空气中的二氧化碳气体
C.反应结束后再需缓缓鼓入空气数分钟
D.若实验操作无误,该装置测得的碳酸钠的质量分数结果偏小
【答案】D
【解析】
该实验的测定原理是:装置丙中碱石灰增重的质量是乙中反应生成二氧化碳的质量,通过二氧化碳的质量来计算碳酸钠的质量,再计算碳酸钠的质量分数。
A.装置乙中的物质是H2SO4和Na2CO3,发生的反应方程式:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O,A正确;
B.装置甲的作用是除去空气中的二氧化碳气体,避免空气中的二氧化碳进入装置丙,影响测定结果,B正确;
C.装置乙和导管中会残留反应生成的二氧化碳,为了把反应生成的二氧化碳全部吹入装置丙中,反应结束后再需缓缓鼓入空气数分钟,C正确;
D.装置丙的右侧和空气相通,空气中的二氧化碳也会被吸收,导致装置丙增重的质量偏大,算出的碳酸钠的质量分数偏大,D错误;
答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目