��Ŀ����
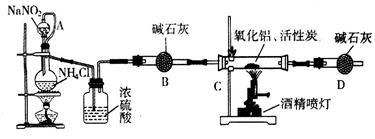
���Ȼ��ף�PCl3����һ����Ҫ���л��ϳɴ�����ʵ���ҳ��ú���������Cl2��ȡPCl3��װ������ͼ��ʾ��
��֪������������Cl2��Ӧ����PCl3�������Cl2��Ӧ����PCl5��PCl3��O2������POCl3(��������)�� POCl3����PCl3��PCl3��ˮ��ǿ��ˮ������H3PO3��HCl��PCl3��POCl3���۷е���±���
| ���� | �۵�/�� | �е�/�� |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
��1��B����װ�Լ��� ��F�м�ʯ�ҵ������� ��
��2��ʵ��ʱ�����װ�������Ժ���Dװ�õ�������м�����ף���K3ͨ������CO2��һ��ʱ��ر�K3��������������ϲ��л�ɫ���������ʱͨ����������Ӧ�������С�ͨ����CO2�������� ��
��3��ʵ���ƵõĴֲ�Ʒ�г�����POCl3��PCl5�ȡ���������ȳ�ȥPCl5��ͨ�� ����ʵ��������ƣ������ɵõ��ϴ�����PCl3��
��4��Cװ���е�K1��K2�����Ҳ�������Ƶ�Ŀ�ģ�Ϊ�˴ﵽ��һʵ��Ŀ�ģ�ʵ��ʱ��K1��K2�йصIJ����� ��
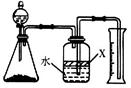
��5��ʵ����ڹر�K1����K2��������ͨ��Cװ���з�����Ӧ����Ӧ�����ҺΪX��ijͬѧ���ʵ����ȷ����ҺX�к��е�ijЩ���ӣ��벹�����ʵ�鲽�������
| ʵ�鲽�� | ʵ������ | ʵ����� |
| �� | | ��ҺX�к���Na+ |
| �� | | ��ҺX�к���Cl- |
��5��������֮���������Ҫ�õ���Ƥ�ܣ����ӵķ����ǣ��Ȱ� ��Ȼ�������������ɰѲ����ܲ�����Ƥ�ܡ���ͬѧ��װ��A��ʾ��ͼ������ͼ����ʾ��ͼ�����ԵĴ����� ��
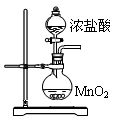
(1) Ũ���ᣨ1�֣����ն����Cl2����ֹ�����е�ˮ����������ƿ��PCl3��Ӧ����2�֣�
(2) �ž�װ���еĿ�������ֹ������ȼ����1�֣�
�ȹر�K1����K2����B����Һ�Ϸ���������ɫ�����K1���ر�K2����2�֣�
(3) ���� ��1�֣�
(4)
��5���Ѳ����ܿ���ˮ��ʪ��1�֣� û�У��þƾ��ƣ����� ��1�֣�ʵ�鲽�� ʵ������ ���ò�˿������������˿��պȡ��ҺX���ھƾ�������������(1��) ����ʻ�ɫ(1��) ��ȡ������ҺX����������ϡHNO3(1��)���ٵμ�����AgNO3��Һ(1��) ���ְ�ɫ������1�֣�
�������������
��1��BΪŨ���ᣬ��ʯ���������ն���������ͷ�ֹ������ˮ������װ�á�
��2��ͨCO2��Ŀ��Ϊ����װ�õĿ�����
��3������
��4���ο��ϱ���
��5��������װ��ʱ����Ҫ��ʪ��ʵ����������������ȡ�
���㣺������ʵ��Ļ���������ʵ����ƺͷ�����

 ��У����ϵ�д�
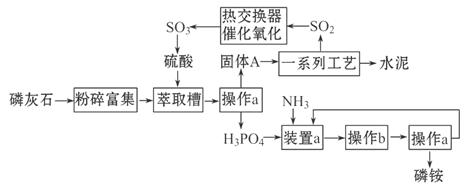
��У����ϵ�д��ߴ��ȵ������ǵ��͵����ǽ������ϣ����Ʊ��뵼�����Ҫ���ϣ����ķ��ֺ�ʹ��������������һ�������������ߴ���ͨ�������·����Ʊ�����̼�ڸ����»�ԭ���������Ƶôֹ裨��Fe��Al��B��P�����ʣ����ֹ���������Ӧ�������Ȼ��裨��Ӧ�¶�Ϊ450��500�棩�����Ȼ��辭�ᴿ����������ԭ�ɵøߴ��衣������ʵ�����Ʊ����Ȼ����װ��ͼ��
�����Ϣ��a�����Ȼ�����ˮ����ˮ�⣻b���������������ڸ����¾���������ֱ�ӻ���������Ӧ���Ȼ��c���й����ʵ������������±���
| ���� | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| �е�/�� | 57.7 | 12.8 | �� | 315 | �� |
| �۵�/�� | ��70.0 | ��107.2 | �� | �� | �� |
| �����¶�/�� | �� | �� | 180 | 300 | 162 |
��ش��������⣺
��1������e������Ϊ ��װ��A��f�ܵ������� �����з�����Ӧ�����ӷ���ʽΪ ��
��2��װ��B�е��Լ��� ��
��3��ijѧϰС���������������ʵ�鷽���������ף�g��װ�â����ң�g��װ�â��Ǽ�������������������װ�þ��в���֮�����������ۺ���д�±���
| ���� | ����֮�� |
| �� | |
| �� | |
��4����������3�������ۻ����ϣ������һ������������ ��
��5��ͨ������������װ����ȡ���ռ����Ĵֲ����ͨ���������ƶ�����õ��ߴ������Ȼ��裬�����IJ������У�����Ԫ������ܻ����е�����Ԫ���� ����дԪ�ط��ţ���
������ͭ�Ǵ���ˮ�潢������Ϳ�����Ҫԭ�ϡ�ijС����������о�������д���пհס�
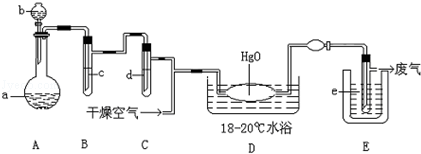
ʵ��1��������ͭ����ȡ������ͭ���������Ǻ�����������ͭ����Һ��Ӧ��ȡ�����ױ������������Ʋ���ʱ��������CuO���ɡ�
��1��ʵ������ȡ������ͭ����Һ�����ӷ���ʽΪ____________��
��2��ʵ�����ô˷�����ȡ���������������ͭ���壬��Ҫ�IJ����������Թܡ��ƾ��ơ��ձ�____________��____________��
��3����Ҫ̽���÷�Ӧ����������¶ȣ�Ӧѡ�õļ��ȷ�ʽΪ____________��
ʵ��2���ⶨ������ͭ�Ĵ���
����1����ȡʵ��1���ù���m g����������װ�ý���ʵ�顣
��4��װ��a�����ӵ�����____________���ѧʽ����
��5��ͨ������������������ܴﵽʵ��Ŀ�ĵ���____________��
| A����Ӧǰ��װ��a������ |
| B��װ��c��ַ�Ӧ�����ù�������� |
| C����Ӧǰ��װ��d������ |
| D����Ӧǰ��װ��e������ |
����2����ʵ��l���ù���mg��������ϡ���ᣬ�����ˡ�ϴ�ӡ������Ƴ�����������������ϣ�Cu2O+2H+=Cu2++Cu+H2O��
��7���жϾ������������IJ������Ƿ�����ȫ����IJ���������__________________________________��
��8����ʵ�����ò�����Ϊng�������Ʒ��������ͭ����������Ϊ________________��
�����й�ʵ�����������ͽ��ͻ���۶���ȷ����(����)
| ѡ�� | ʵ����� | �֡��� | ���ͻ���� |
| A | ������Fe���м���ϡHNO3����ַ�Ӧ����KSCN��Һ | ��Һ�ʺ�ɫ | ϡHNO3��Fe����ΪFe3�� |
| B | AgI�����е���ϡKCl��Һ | �а�ɫ�������� | AgCl��AgI������ |
| C | Al������ϡHNO3�� | ������ | Al�����汻HNO3�������γ����ܵ�����Ĥ |
| D | �ò�����պȡŨ��ˮ�㵽��ɫʯ����ֽ�� | ��ֽ����ɫ | Ũ��ˮ�ʼ��� |
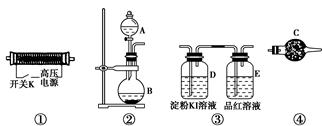



 ��
��