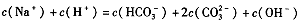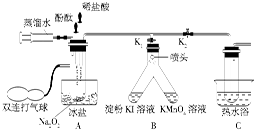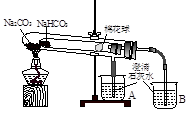题目内容
化学兴趣小组设计以下实验方案,测定某已部分变质的小苏打样品中Na2CO3的质量分数。
【方案一】 称取一定质量的固体样品,通过加热至恒重后冷却,称量剩余固体质量,计算。
(1)下列仪器中,在灼烧固体样品时必须用到的是 (填名称)。
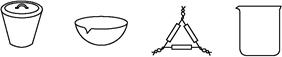
(2)实验中需加热至恒重的目的是: 。
(3)实验中确定加热至恒重的方法是: 。
(4)若加热过程中有晶体迸溅出来,则测得的结果 (填“偏大”、“偏小”或“不变”)。
【方案二】 称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(已知:Ba2++OH-+HC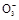
 BaCO3↓+H2O)
BaCO3↓+H2O)
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是 。
(3)实验中洗涤沉淀的操作是 。
(4)实验中判断沉淀是否洗涤干净的方法是 。
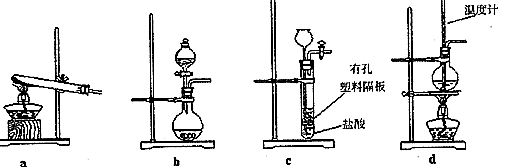
【方案三】 按如图所示装置进行实验:
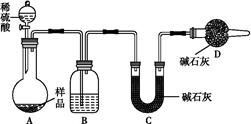
(1)B装置内所盛试剂是 ;D装置的作用是 ;分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是 。
【方案一】 称取一定质量的固体样品,通过加热至恒重后冷却,称量剩余固体质量,计算。
(1)下列仪器中,在灼烧固体样品时必须用到的是 (填名称)。

(2)实验中需加热至恒重的目的是: 。
(3)实验中确定加热至恒重的方法是: 。
(4)若加热过程中有晶体迸溅出来,则测得的结果 (填“偏大”、“偏小”或“不变”)。
【方案二】 称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤,干燥沉淀,称量固体质量,计算。
(已知:Ba2++OH-+HC
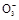
 BaCO3↓+H2O)
BaCO3↓+H2O)(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为 。
(2)实验中判断沉淀是否完全的方法是 。
(3)实验中洗涤沉淀的操作是 。
(4)实验中判断沉淀是否洗涤干净的方法是 。
【方案三】 按如图所示装置进行实验:

(1)B装置内所盛试剂是 ;D装置的作用是 ;分液漏斗中 (填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(2)实验前称取17.9 g样品,实验后测得C装置增重8.8 g,则样品中Na2CO3的质量分数为 。
(3)根据此实验测得的数据,测定结果有误差,因为实验装置还存在一个明显缺陷是 。
【方案一】 (1)坩埚、泥三角
(2)保证NaHCO3分解完全
(3)两次称量固体的质量差不超过0.1 g
(4)偏小
【方案二】 (1)玻璃棒
(2)静置,向上层清液滴加一滴Ba(OH)2溶液,观察是否有白色沉淀生成
(3)向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2~3次
(4)取少量最后一次洗涤沉淀的滤液于试管中,滴加一滴Na2SO4溶液,观察是否有白色沉淀生成
【方案三】 (1)浓H2SO4 防止空气中的水蒸气、CO2进入C装置 不能
(2)29.6%
(3)缺少一套将A、B内的CO2气体驱赶到C里的装置(或其他合理答案)
(2)保证NaHCO3分解完全
(3)两次称量固体的质量差不超过0.1 g
(4)偏小
【方案二】 (1)玻璃棒
(2)静置,向上层清液滴加一滴Ba(OH)2溶液,观察是否有白色沉淀生成
(3)向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2~3次
(4)取少量最后一次洗涤沉淀的滤液于试管中,滴加一滴Na2SO4溶液,观察是否有白色沉淀生成
【方案三】 (1)浓H2SO4 防止空气中的水蒸气、CO2进入C装置 不能
(2)29.6%
(3)缺少一套将A、B内的CO2气体驱赶到C里的装置(或其他合理答案)
【方案一】 小苏打受热分解,根据反应前后固体质量的变化,可以测定小苏打样品中Na2CO3的质量分数。(1)给固体灼烧需用到的仪器有:酒精灯、三脚架、坩埚、泥三角、坩埚钳。(2)加热至恒重的目的是保证NaHCO3分解完全。(3)当两次称量剩余固体的质量差不超过0.1 g时,说明已经加热至恒重。(4)加热过程中迸溅出晶体时,最后剩余的固体质量减小,求出的小苏打的质量增大,进而求出的苏打的质量减小。
【方案二】 (1)过滤操作中用到的仪器有:铁架台(附铁圈)、烧杯、漏斗、玻璃棒、滤纸。(2)判断沉淀是否完全的方法是:静置,向上层清液中继续滴加沉淀剂,若有沉淀生成,则说明沉淀不完全;若无沉淀生成,则说明沉淀已完全。(3)洗涤沉淀的操作是向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2~3次。(4)要判断沉淀是否洗干净就要分析如果没有洗净,洗涤液中含有何种易于鉴别的离子,然后取最后一次的洗涤液,选择适当的试剂进行实验,该题若没有洗干净,会含有OH-、Ba2+、HC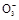 、C
、C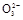 离子,现象明显的是用S
离子,现象明显的是用S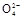 鉴别Ba2+。
鉴别Ba2+。
【方案三】 (1)A装置是将样品中的Na2CO3、NaHCO3完全转化为CO2,产生的CO2被C装置吸收,通过称量C装置吸收前后的质量差(即产生的CO2的质量),可以求出Na2CO3和NaHCO3的质量,进而求出小苏打样品中Na2CO3的质量分数。由于碱石灰既能吸收CO2又能吸收水蒸气,所以从A装置中出来的气体在进入C装置前,必须除去CO2气体中的水蒸气,C装置后面必须连接一防止空气中的水蒸气、CO2进入的装置。用盐酸代替稀硫酸进行实验时,挥发出来的HCl气体会被C装置吸收而导致测定结果不准确。(2)设样品中Na2CO3的物质的量为x,NaHCO3的物质的量为y。则有:44 g·mol-1(x+y)="8.8" g,106 g·mol-1 x+84 g·mol-1 y="17.9" g,解得:
x="0.05" mol,y="0.15" mol。可求出样品中Na2CO3的质量分数为29.6%。(3)由于A、B装置内的CO2气体无法完全进入C装置里,导致实验测得的结果有误差,应增加一套将A、B内的CO2气体驱赶到C里的装置(合理
即可)。
【方案二】 (1)过滤操作中用到的仪器有:铁架台(附铁圈)、烧杯、漏斗、玻璃棒、滤纸。(2)判断沉淀是否完全的方法是:静置,向上层清液中继续滴加沉淀剂,若有沉淀生成,则说明沉淀不完全;若无沉淀生成,则说明沉淀已完全。(3)洗涤沉淀的操作是向漏斗里加入蒸馏水,使水面没过沉淀物,等水自然流完后,重复操作2~3次。(4)要判断沉淀是否洗干净就要分析如果没有洗净,洗涤液中含有何种易于鉴别的离子,然后取最后一次的洗涤液,选择适当的试剂进行实验,该题若没有洗干净,会含有OH-、Ba2+、HC
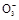 、C
、C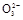 离子,现象明显的是用S
离子,现象明显的是用S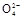 鉴别Ba2+。
鉴别Ba2+。【方案三】 (1)A装置是将样品中的Na2CO3、NaHCO3完全转化为CO2,产生的CO2被C装置吸收,通过称量C装置吸收前后的质量差(即产生的CO2的质量),可以求出Na2CO3和NaHCO3的质量,进而求出小苏打样品中Na2CO3的质量分数。由于碱石灰既能吸收CO2又能吸收水蒸气,所以从A装置中出来的气体在进入C装置前,必须除去CO2气体中的水蒸气,C装置后面必须连接一防止空气中的水蒸气、CO2进入的装置。用盐酸代替稀硫酸进行实验时,挥发出来的HCl气体会被C装置吸收而导致测定结果不准确。(2)设样品中Na2CO3的物质的量为x,NaHCO3的物质的量为y。则有:44 g·mol-1(x+y)="8.8" g,106 g·mol-1 x+84 g·mol-1 y="17.9" g,解得:
x="0.05" mol,y="0.15" mol。可求出样品中Na2CO3的质量分数为29.6%。(3)由于A、B装置内的CO2气体无法完全进入C装置里,导致实验测得的结果有误差,应增加一套将A、B内的CO2气体驱赶到C里的装置(合理
即可)。

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目