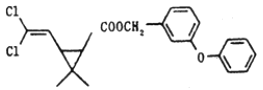
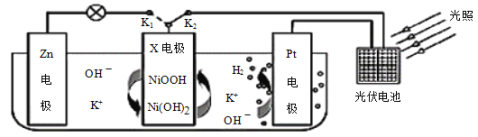
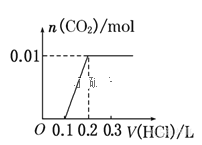
题目内容
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取铝的原料。提取铝的工艺流程如下:
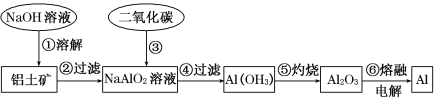
(1)请用离子方程式表示以上工艺流程中第①步反应:_____________________。
(2)写出以上工艺流程中第③步反应的离子方程式:___________________________。
(3)若第③步加入的是过量的盐酸,则发生反应的化学方程式为_____________。
【答案】Al2O3+2OH-=2 AlO2﹣+H2O AlO2﹣+CO2+2H2O=HCO3-+Al(OH)3↓ NaAlO2+4HCl=NaCl+AlCl3+2H2O
【解析】
提取铝的工艺流程:操作①Al2O3和氢氧化钠反应生成偏铝酸钠和水,②过滤,③向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠,④过滤,⑤氢氧化铝灼烧后会生成氧化铝,⑥电解氧化铝熔融物可以得到金属铝,据此分析解答。
(1)氧化铝属于两性氧化物,能溶于强酸和强碱,所以氧化铝和氢氧化钠反应生成可溶性的偏铝酸钠和水,离子方程式为:Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)向偏铝酸钠中通入过量的二氧化碳可以生成氢氧化铝沉淀和碳酸氢钠,发生的反应为:NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,对应的离子反应方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)第③步加入的是过量的盐酸,氢氧化铝又转化为氯化铝,反应的化学方程式为NaAlO2+4HCl=NaCl+AlCl3+2H2O,故答案为:NaAlO2+4HCl=NaCl+AlCl3+2H2O。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案