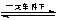题目内容
下列离子方程式书写正确的是
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O= AlO2-↓+4NH4++2H2O
B.钠投入水中:Na+H2O=Na++2OH-+H2↑
C.铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
D.氢氧化钡溶液滴入稀硫酸中:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D
【解析】
试题分析:A、氯化铝溶液中加入过量氨水生成的氢氧化铝沉淀难溶于氨水,错误;B、电荷不守恒,错误;C、铁与稀硫酸反应生成亚铁离子,不符合事实,错误;D、氢氧化钡溶液滴入稀硫酸中生成硫酸钡沉淀和水均不能拆开,符合离子方程式的书写原则,正确,答案选D。
考点:考查离子方程式的书写

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目