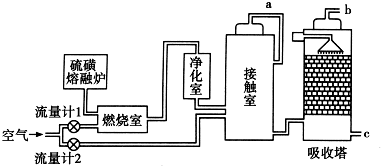
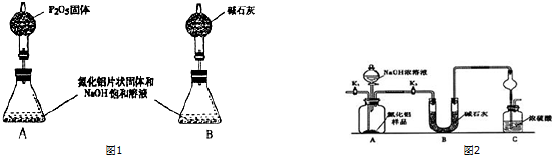
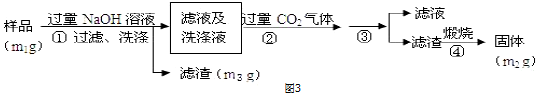
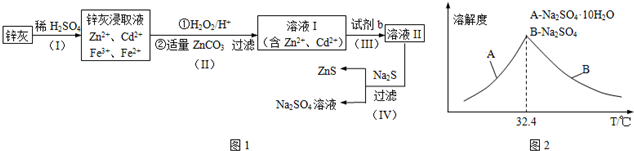
题目内容
3.某500mL溶液中含0.1mo1 Fe2+、0.2mol Fe3+,加人0.2mol铁粉.待Fe3+完全还原后.溶液中Fe2+的物质的量浓度为(假设反应前后体积不变)0.8mol/L.分析 加铁粉,发生反应Fe+2Fe3+=3Fe2+,根据反应可知0.2molFe3+完全被还原只需要0.1molFe,从而可计算出反应后溶液中亚铁离子的物质的量,然后根据c=$\frac{n}{V}$计算出反应后溶液中Fe2+的物质的量浓度.
解答 解:加入铁粉,发生Fe+2Fe3+=3Fe2+,溶液中含0.2molFe3+,待Fe3+完全还原后,由反应可知消耗Fe的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,
Fe有剩余,反应生成Fe2+为0.2mol×$\frac{3}{2}$=0.3mol,则反应后溶液中含Fe2+的物质的量为:0.1mol+0.3mol=0.4mol,
所以溶液中Fe2+的物质的量浓度为:$\frac{0.4mol}{0.5L}$=0.8mol/L,
故答案为:0.8mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确发生反应的实质为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
14.某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究.

(1)装置A中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置B的作用是防止C中液体倒吸入A中(或防倒吸,或安全瓶).
(2)设计装置D的目的是验证SO2的还原性,E中NaOH全部转化为NaHSO3的标志是溶液红色褪去.
(3)装置C的作用是贮存多余的气体,C中应放置的液体是饱和NaHSO3溶液.
(4)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量.经冷却,定量稀释后进行下列实验,能达到目的是b c(填序号);
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用PH计测溶液PH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(5)向E瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
(6)请设计简单实验证明室温下HSO3-的电离平衡常数Ka与水解平衡常教Kb的相对大小常温下,用pH试纸(或pH计)测定NaHS03溶液的pH,若pH<7,则Ka>Kb,若pH>7,则Ka<Kb.

(1)装置A中发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置B的作用是防止C中液体倒吸入A中(或防倒吸,或安全瓶).
(2)设计装置D的目的是验证SO2的还原性,E中NaOH全部转化为NaHSO3的标志是溶液红色褪去.
(3)装置C的作用是贮存多余的气体,C中应放置的液体是饱和NaHSO3溶液.
(4)反应结束时烧瓶中Cu有剩余,某同学认为H2SO4也有剩余,他设计了下列实验方案来测定剩余H2SO4的量.经冷却,定量稀释后进行下列实验,能达到目的是b c(填序号);
a.用酸碱中和滴定法测定 b.与足量Zn反应,测量生成H2的体积
c.用PH计测溶液PH值 d.与足量BaCl2溶液反应,称量生成沉淀的质量
(5)向E瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
| 实验序号 | 实验操作 | 现象 | 反应的可能情况 |
| ① | 滴加少量淀粉碘化钾溶液,振荡 | III | |
| ② | 滴加少量棕红色的KI3溶液,振荡 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振荡 | 溶液呈紫色 | |
| ④ | 加入几小块CaCO3固体 | 有气泡产生 |
18.下列各组中的固体物质,只需加水就可以鉴别的一组是( )
| A. | CaCO3、BaSO4、Na2CO3 | B. | CuSO4、NaCl、NaCO3 | ||
| C. | NaCl、CuSO4、CaCO3 | D. | NaCl、KNO3、BaCl2 |