题目内容
5.硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g)△H<0(1)如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用O2浓度变化来表示的反应速率为1mol•L-1•min-1.
(2)某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图1所示.根据图示回答下列问题:

该反应的平衡常数的表达式为K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$平衡状态由A变到B时平衡常数K(A)=K(B)(填“>”、“<”或“=”).
(3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是AD(填字母).
A.接触室中气体的平均相对分子质量不再改变 B.接触室中SO2、O2、SO3的浓度相同C.接触室中SO2、SO3的物质的量之比为2:1:2 D.接触室中压强不随时间变化而变化(4)图2表示该反应在密闭容器中达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升温;b~c过程中改变的条件可能是减小SO3浓度; 若增大压强时,请把反应速率变化情况画在c~d处.
分析 (1)根据v=$\frac{△c}{△t}$和化学反应速率之比等化学计量数之比进行计算,得出正确结论;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,温度不变,则平衡常数K不变;
(3)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析;根据正逆反应速率的变化结合温度、压强对反应速率和化学平衡的影响判断,a时逆反应速率大于正反应速率,且正逆反应速率都增大,b时正反应速率大于逆反应速率,注意逆反应速率突然减小的特点.
解答 解:(1)v(SO2)=$\frac{6mol/L-2mol/L}{2min}$=2 mol•L-1•min-1;v(O2):v(SO2)=1:2,v(O2)=$\frac{1}{2}$v(SO2)=1mol•L-1•min-1,故答案为:1mol•L-1•min-1;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故可逆反应2NO(g)+2CO(g)?N2(g)+2CO2(g) 的平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$,平衡常数只受温度的影响,温度不变,则压强不变,平衡状态由A变到B时,则K(A)=K(B),故答案为:K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})•c({O}_{2})}$;=;
(3)A.气体的总质量不变,随反应进行,气体的物质的量减小,平均相对分子质量增大,平均相对分子质量不变,说明到达平衡状态,故A正确;
B.平衡时接触室中SO2、O2的浓度一定不相同,开始物质的量为2:1,按2:1反应,平衡时二者的物质的量之比为2:1,浓度之比为2:1,故B错误;
C.平衡时接触室中SO2、O2、SO3物质的量之比可能为2:1:2,可能不是2:1:2,与二氧化硫的转化率有关,故C错误;
D.随反应进行,气体的物质的量减小,接触室中压强减小,压强不随时间变化而变化,说明到达平衡状态,故D正确;
故选AD; a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因,若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为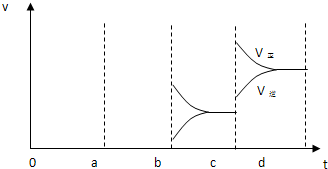 ,
,
故答案为:AD;升温; 减小SO3浓度; .
.
点评 本题考查化学反应速率与化学平衡的图象问题、平衡常数的计算、平衡状态的判断等,难度中等,注意把握曲线的变化趋势以及外界条件对化学平衡的影响.

| A. | 与稀盐酸反应放出气体的快慢:Na2CO3>NaHCO3 | |
| B. | 配制成同物质的量浓度的溶液时,溶液的pH:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量的盐酸反应,放出CO2的质量:Na2CO3>NaHCO3 | |
| D. | 在Na2CO3和NaHCO3的稀溶液中,加CaCl2溶液都有白色沉淀生成 |
| A. | ①②③④ | B. | ②③④① | C. | ②①③④ | D. | ④②③① |
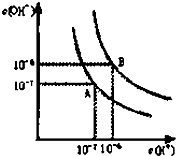 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:
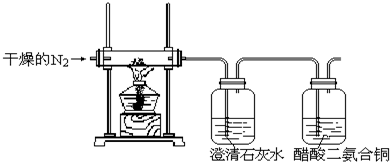
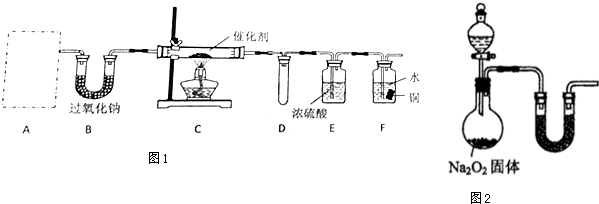
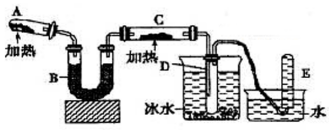 己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.
己知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应.