题目内容
1.某同学做元素性质递变规律实验时,自己设计了一套实验方案如表,请按要求完成表格:(1)实验目的:探究同周期元素性质递变规律.
(2)实验内容:写出相应的离子方程式
| 实验方案 | 实验现象 | 有关离子方程式 |
| ①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | Mg+2H2O(热水)═Mg(OH)2+H2↑ | |
| ②钠与滴有酚酞试液的冷水反应 | 2Na+2H2O=2Na++2OH-+H2↑ | |
| ③镁带与2mol/L的盐酸反应 | Mg+2H+═Mg2++H2↑ | |
| ④铝条与2mol/L的盐酸反应 | 2Al+6H+=2Al3++3H2↑ |
分析 (1)根据表中实验方案内容可知实验目的是探究同周期元素性质递变规律;
(2)②钠与冷水反应生成强氧化钠和氢气;④铝与盐酸反应生成氯化铝和氢气,据此写出反应的离子方程式.
解答 解:(1)根据实验方案可知,该实验探究了同周期的金属钠、镁、铝的性质的递变规律,则该实验目的为:探究同周期元素性质递变规律,
故答案为:探究同周期元素性质递变规律;
(2)②钠与滴有酚酞试液的冷水反应生成强氧化钠和氢气,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;
④铝条与2mol/L的盐酸反应生成氯化铝和氢气,反应的离子方程式为:2Al+6H+=2 Al3++3H2↑,
故答案为:2Al+6H+=2 Al3++3H2↑.
点评 本题考查了同一周期元素的递变规律及离子方程式书写,题目难度中等,明确元素周期律内容为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
9.(1)Ⅰ.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第IIA族.

Ⅱ.图B折线c可以表达出第IA族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
Ⅲ.部分有机物的熔沸点见下表:
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):
有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为3d24s2;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的23.则绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.

Ⅱ.图B折线c可以表达出第IA族元素氢化物的沸点的变化规律.两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:b(填“a”或“b”)
Ⅲ.部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |  |  |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
有机物相对分子质量越大,分子间作用力越强,故沸点越高,当有机物能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高.
(2)COCl2俗称光气,分子中C原子采取sp2杂化成键;其中碳氧原子之间共价键含有c(填字母):
a.2个σ键;b.2个π键;c.1个σ键.1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
Ⅰ.Ti元素的基态原子的价电子层排布式为3d24s2;
Ⅱ.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现产生的沉淀质量关系为:绿色晶体为紫色晶体的23.则绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
12. 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、500 mL 容量瓶、胶头滴管以及等质量的几片滤纸.
(2)计算.配制该溶液需取NaCl晶体的质量为14.6g.
(3)称量.
①天平调平之后,应将天平的游码调至某个位置,请在图中用一根竖线标出游码左边缘所处的位置:
②称量过程中NaCl晶体应放于天平的左盘(填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解.该步实验中需要使用玻璃棒,目的是搅拌,加速溶解.
(5)转移、洗涤.在转移时应使用玻璃棒引流,洗涤烧杯2~3次是保证溶质全部转移至容量瓶中.
(6)定容,摇匀.
(7)在配制溶液(或者稀释浓溶液)的过程中,存在引起误差的一些错误操作,可能造成所配溶液的浓度会受到影响,请完成表格(在空格处填偏大、偏小或者无影响).
 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、500 mL 容量瓶、胶头滴管以及等质量的几片滤纸.
(2)计算.配制该溶液需取NaCl晶体的质量为14.6g.
(3)称量.
①天平调平之后,应将天平的游码调至某个位置,请在图中用一根竖线标出游码左边缘所处的位置:
②称量过程中NaCl晶体应放于天平的左盘(填“左盘”或“右盘”).
③称量完毕,将药品倒入烧杯中.
(4)溶解.该步实验中需要使用玻璃棒,目的是搅拌,加速溶解.
(5)转移、洗涤.在转移时应使用玻璃棒引流,洗涤烧杯2~3次是保证溶质全部转移至容量瓶中.
(6)定容,摇匀.
(7)在配制溶液(或者稀释浓溶液)的过程中,存在引起误差的一些错误操作,可能造成所配溶液的浓度会受到影响,请完成表格(在空格处填偏大、偏小或者无影响).
| 引起误差的一些错误操作 | 对CB的影响 |
| 定容时,俯视刻度线 | 偏大 |
| 转移溶液时,玻璃棒下端靠在容量瓶刻度线以上 | 偏小 |
| 洗涤量取浓溶液的量筒并将洗涤液转移到容量瓶 | 偏大 |
| 定容后,经振荡、摇匀、静置、液面低于刻度线再加水 | 偏小 |
9.下列装置或操作能达到实验目的是( )
| A. | 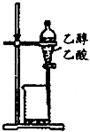 除去乙醇中的乙酸 | B. | 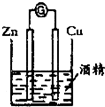 形成原电池 | ||
| C. |  制取乙酸乙酯 制取乙酸乙酯 | D. | 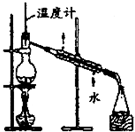 石油的分馏 |
6.宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记录,“银针验毒”的原理是4Ag+2H2S+O2═2Ag2S+2H2O下列有关该反应的说法正确的是( )
| A. | Ag是氧化物 | B. | O2被氧化 | ||
| C. | H2S发生还原反应 | D. | H2S未发生电子转移 |
13.工厂用FeCl3溶液腐蚀表面有铜的印刷电路板,课外活动小组为确定生产后废液的组成,进行如下实验:
①取10.0mol废液加入足量的AgNO3溶液,产生沉淀8.61g
②另取10.0mol废液放入足量铜片充分反应,铜片质量减少了0.256g,下列关于原废液组成的判断正确的是( )
①取10.0mol废液加入足量的AgNO3溶液,产生沉淀8.61g
②另取10.0mol废液放入足量铜片充分反应,铜片质量减少了0.256g,下列关于原废液组成的判断正确的是( )
| A. | 只含有Fe2+、Cu2+、Cl- | |
| B. | c(Fe2-):c(Cu2+)=1:2 | |
| C. | c(Cl-)=6.0mol.L-1,c(Fe2+)=1.2mol.L-1 | |
| D. | c(Fe2+):c(Fe3+)=3:1 |
10.在下列有色试剂褪色现象中,其褪色原理相同的是( )
| A. | 乙烯能使溴水和酸性KMnO4溶液褪色 | |
| B. | Cl2和SO2均能使品红褪色 | |
| C. | 苯和乙炔都能使溴水褪色 | |
| D. | 甲苯和乙醛均能使酸性KMnO4溶液褪色 |
11.甲苯与苯的性质相似,但甲苯能使酸性KMnO4溶液褪色.现有己烯(液态、化学性质与乙烯类似)、苯和甲苯3份无色液体,下列能将3份液体鉴别开的试剂是( )
| A. | 酸性KMnO4溶液 | B. | 溴水 | ||
| C. | NaOH溶液 | D. | 酸性KMnO4溶液和溴水 |