题目内容
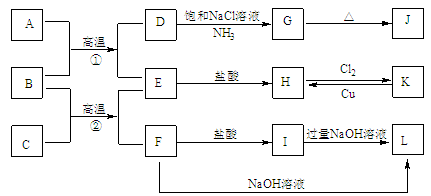
【题目】下图是一些常见单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质,G、J的焰色均为黄色。反应①为炼铁高炉中的重要反应;反应②可用于焊接铁轨。
请回答下列问题:
(1)B的化学式为 ,J的化学式为 。
(2)工业上将氯气通入石灰乳中制取漂白粉,该反应的化学反应方程式为 。
(3)D→G是侯氏制碱法的主要反应,该反应的化学方程式为 。
(4)K→H是制作印刷电路板的重要反应,该反应的离子方程式为 。
(5)F→L是铝土矿提纯中的重要反应,该反应的离子方程式为 。
【答案】(1)Fe2O3,Na2CO3;
(2)2Cl2+ 2Ca(OH)2 ![]() CaCl2+ Ca(ClO)2+ 2H2O;
CaCl2+ Ca(ClO)2+ 2H2O;
(3)NaCl+ CO2+ NH3+ H2O ![]() NaHCO3+ NH4Cl;
NaHCO3+ NH4Cl;
(4)2Fe3+ + Cu ![]() 2Fe2+ + Cu2+;
2Fe2+ + Cu2+;
(5)Al2O3 +2 OH- ![]() 2AlO2- + H2O。
2AlO2- + H2O。
【解析】
试题分析:反应①为炼铁高炉中重要的反应,A为无色有毒气体,B为红棕色粉末,因此有A:CO,B:Fe2O3,反应②可用于焊接铁轨,是铝热反应,即C:Al,D:CO2,G的焰色为黄色,则G为NaHCO3,NaHCO3不稳定,受热易分解,J为Na2CO3,E: Fe,H: FeCl2,K: FeCl3,F: Al2O3,I: Al(OH)3,L: NaAlO2,
(1)根据上述分析得出B的化学式为Fe2O3,J的化学式为Na2CO3;(2)氯气自身发生氧化还原反应,其反应方程式为2Cl2+ 2Ca(OH)2 ![]() CaCl2+ Ca(ClO)2+ 2H2O;(3)利用了NaHCO3溶解度小于Na2CO3的特点,NaCl+ CO2+ NH3+ H2O
CaCl2+ Ca(ClO)2+ 2H2O;(3)利用了NaHCO3溶解度小于Na2CO3的特点,NaCl+ CO2+ NH3+ H2O ![]() NaHCO3+ NH4Cl;(4)利用Fe3+的强氧化性,2Fe3+ + Cu
NaHCO3+ NH4Cl;(4)利用Fe3+的强氧化性,2Fe3+ + Cu ![]() 2Fe2+ + Cu2+;(5)利用Al2O3表现两性,Al2O3 +2 OH-
2Fe2+ + Cu2+;(5)利用Al2O3表现两性,Al2O3 +2 OH- ![]() 2AlO2- + H2O。
2AlO2- + H2O。

 阅读快车系列答案
阅读快车系列答案【题目】由CO和H2S反应可制得羰基硫(COS)。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g),数据如下表所示:
COS(g)+H2(g),数据如下表所示:
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
下列说法正确的是( )
A. 上述反应是吸热反应
B. 实验1达平衡时,CO的转化率为70%
C. 实验2达平衡时,a<7.0
D. 实验3达平平衡后,再充入1.0molH2,平衡逆向移动,平衡常数值增大