题目内容
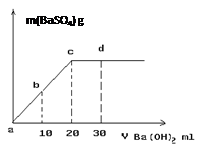
(12分)按图所示实验过程填空:
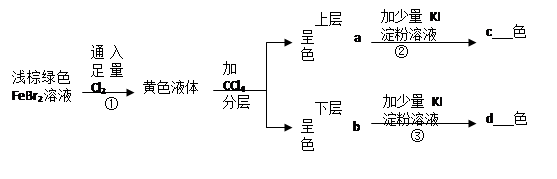
(1)写出上述反应的离子方程式:
① ② ③
(2)填空:
a b c d
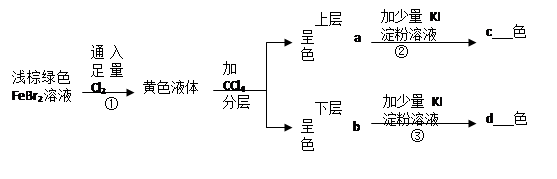
(1)写出上述反应的离子方程式:
① ② ③
(2)填空:
a b c d
(1)① 2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 (2分)
② 2Fe3++2I-=2Fe2++I2 (3分) ③ Br2+2I-=2Br-+I2 (3分)
(2) a 棕黄 b 橙红 c蓝 d 蓝色 (各1分)
② 2Fe3++2I-=2Fe2++I2 (3分) ③ Br2+2I-=2Br-+I2 (3分)
(2) a 棕黄 b 橙红 c蓝 d 蓝色 (各1分)
试题分析:①发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2,所得的黄色液体为溴水。加CCl4后分层,上层为FeCl3溶液,呈棕黄色;下层为溴的CCl4溶液,呈橙红色;②发生的反应为:2Fe3++2I-=2Fe2++I2,反应后所得的溶液的溶质为I2,I2遇淀粉变蓝色。③发生的反应为:Br2+2I-=2Br-+I2,淀粉遇碘变蓝色。
点评:此题考查卤素单质之间的相互转换,属于基础题。对于卤素单质,应特别注意其颜色。

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2 离子在一定条件下可以把Mn2+离子氧化为
离子在一定条件下可以把Mn2+离子氧化为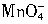 ,若反应后
,若反应后 离子变为
离子变为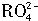 离子,
离子, Al(OH)4- + H+ (B) NH3 + H2O
Al(OH)4- + H+ (B) NH3 + H2O  NH4+ + OH-
NH4+ + OH-