题目内容
(14分)(1)服用含碘化钾的碘药片可抗核辐射。将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:
①溶液颜色由无色变蓝色的理由: (用离子反应方程式表示);
②完成并配平溶液颜色由蓝色变为无色的化学反应方程式(如果系数是1,不用填写):
+ + → HIO3 +
(2)观察如下反应,总结规律,然后完成下列问题:
(A) Al(OH)3 + H2O Al(OH)4- + H+ (B) NH3 + H2O
Al(OH)4- + H+ (B) NH3 + H2O  NH4+ + OH-
NH4+ + OH-
①已知B(OH)3是一元弱酸,其电离方程式为 ;
②N2H4是二元弱碱,其电离方程式为 。
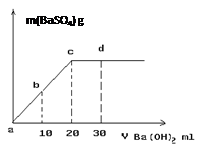
(3)常温下,向1.0mol/L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈 (填“酸性”、“中性”、或“碱性”),c点所示的离子方程式为 。
(4)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显 性(填“酸性”、“中性”、或“碱性”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
①溶液颜色由无色变蓝色的理由: (用离子反应方程式表示);
②完成并配平溶液颜色由蓝色变为无色的化学反应方程式(如果系数是1,不用填写):
+ + → HIO3 +
(2)观察如下反应,总结规律,然后完成下列问题:
(A) Al(OH)3 + H2O
 Al(OH)4- + H+ (B) NH3 + H2O
Al(OH)4- + H+ (B) NH3 + H2O  NH4+ + OH-
NH4+ + OH-①已知B(OH)3是一元弱酸,其电离方程式为 ;
②N2H4是二元弱碱,其电离方程式为 。
(3)常温下,向1.0mol/L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈 (填“酸性”、“中性”、或“碱性”),c点所示的离子方程式为 。

(4)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显 性(填“酸性”、“中性”、或“碱性”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
(1) ①Cl2 + 2I_ = 2Cl_ + I2 (2分)
② 5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl(2分)
(2)①B(OH)3 + H2O B(OH)4- + H+ (2分)
B(OH)4- + H+ (2分)
② N2H4 +2H2O N2H62+ +2OH_或分部水解均可 (2分)
N2H62+ +2OH_或分部水解均可 (2分)
(3)中性(1分) SO42- + Ba2+ = BaSO4↓(2分)
(4)中性(1分),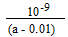 (2分)
(2分)
② 5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl(2分)
(2)①B(OH)3 + H2O
 B(OH)4- + H+ (2分)
B(OH)4- + H+ (2分) ② N2H4 +2H2O
 N2H62+ +2OH_或分部水解均可 (2分)
N2H62+ +2OH_或分部水解均可 (2分)(3)中性(1分) SO42- + Ba2+ = BaSO4↓(2分)
(4)中性(1分),
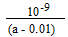 (2分)
(2分)试题分析:(1) ①氯水具有强氧化性,将碘离子氧化为碘单质,使溶液颜色由无色变蓝色 ; ② 继续滴加氯水,发生反应5Cl2 + I2 + 6H2O = 2HIO3 + 10HCl,使得蓝色溶液又褪为无色;
(2)①Al(OH)3是两性的,可看为弱酸,故弱酸的水解同Al(OH)3一样;②N2H4为碱,故水解同NH3;
(3)c点时,[OH-]=2[H+],b点位a、c的中点,加入的[OH-]=[H+],故溶液为中性;c点以前,H+已经全部被消耗掉,故c点时离子方程式为 SO42- + Ba2+ = BaSO4↓;
(4)溶液中c(NH4+)=c(Cl-),则有[OH-]=[H+],故溶液为中性;
[OH-]= 10-7mol/L,c(NH4+)=c(Cl-)=0.01mol/L,[NH3.H2O](反应后)=[NH3.H2O](开始)-[NH4+]=(a-0.01)mol/L.故
NH3·H2O的电离常数Kb=[OH-][NH4+]/[NH3.H2O](反应后)=
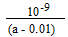 。
。点评:本题通过碘离子与氯水的反应,考查学生对离子方程式书写的掌握,并考查了与反应物量相关的反应不同用量时的离子方程式,计算电离常数时,理解其含义即是解题关键。

练习册系列答案
相关题目
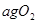 同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为
同时装入一个装有压力表体积不变的密闭容器中,压力表所示压强为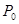 ,高温下容器中木炭与
,高温下容器中木炭与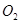 均完全反应后恢复到原温度,压力表的示数为
均完全反应后恢复到原温度,压力表的示数为 ,试求:
,试求: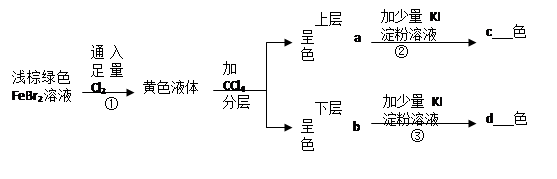

 (1)图中①为 ,②为 。
(1)图中①为 ,②为 。