题目内容
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6L.Cl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
【答案】A
【解析】Cl2与足量NaOH反应生成氯化钠和次氯酸钠,1mol氯气转移1mol电子,所以标准状况下,5.6LCl2与足量NaOH反应转移的电子数为0.25NA,故A正确;室温下, pH=13的NaOH溶液中,由水电离的OH-离子的浓度是![]() ,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为
,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为![]() NA,故B错误;氢氧燃料电池正极是氧气得电子,1mol氧气得4mol电子,所以消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA,故C错误;根据方程式5NH4NO3
NA,故B错误;氢氧燃料电池正极是氧气得电子,1mol氧气得4mol电子,所以消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA,故C错误;根据方程式5NH4NO3![]() 2HNO3+4N2↑+9H2O,生成4molN2转移15mol电子,所以生成56gN2时,转移的电子数目为7.5NA,故D错误。
2HNO3+4N2↑+9H2O,生成4molN2转移15mol电子,所以生成56gN2时,转移的电子数目为7.5NA,故D错误。

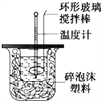
【题目】利用下图图装置测定中和热的实验步骤如下:
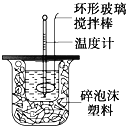
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。回答下列问题:
(1)倒入NaOH溶液的正确操作是________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
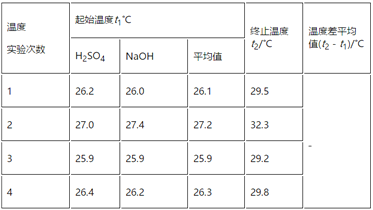
(3)实验数据如下表:①请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH=____________________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是________。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度