题目内容
(分)A、B、C、D、E、F六种元素(前20号元素)的核电荷数依次增大。C是地壳中含量最高的元素;D的最高价氧化物的水化物分别能与E、F的最高价氧化物的水化物反应;E原子的最外层电子数是其最内层电子数的3倍;F元素是化学肥料中一种重要元素,其原子的次外层电子数与倒数第三层的电子数相等;A与F具有相同的最外层电子数;B元素的某种单质常作为干电池中的电极材料。试回答下列问题:
(1)由A、B两元素按原子个数之比为1︰1组成的某分子,其相对分子质量小于30,请写出实验室制备该物质的化学反应方程式 。
(2)D、E、F三种元素的原子半径由大到小顺序是 (用元素符号表示)。
(3)由C、D、E、F四种元素组成的某盐,可用作净水剂,也可用于制作膨化食品。该盐的化为 ,将该盐溶液与Ba(OH)2溶液按溶质物质的量之比1:2混合反应,此反应的离子方程式为 。
(1)CaC2 + 2H2O → Ca(OH)2 + C2H2 ↑ (2分)
(2)r(K)>r(Al)>r(S) 或K >Al >S (2分)
(3)KAl(SO4)2 (2分)
Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O (2分)
解析:
本题考查原子结构,元素周期律知识;由C是地壳中含量最高的元素,可知C为O;F元素是化学肥料中一种重要元素,其原子的次外层电子数与倒数第三层的电子数相等,则F为K,其最高价氧化物对应的水化物为KOH;B元素的某种单质常作为干电池中的电极材料,可推测B为碳;E原子的最外层电子数是其最内层电子数的3倍,可推测E为O或S,但O 无含氧酸,则E为硫,其最高价氧化物对应的水化物为H2SO4;D的最高价氧化物的水化物能与KOH、H2SO4反应,则D为铝;A与F具有相同的最外层电子数,且可与B按1:1组成分子,可推测A为氢。(1)由A、B按1:1组成的分子,且相对分子质量小于30的分子为C2H2,实验室制取C2H2的化学方程式为CaC2 + 2H2O → Ca(OH)2 + C2H2 ↑ (2)K 、Al 、S原子半径大小关系为: K >Al >S (3)K、Al、S、O组成的净水剂为KAl(SO4)2 ;
该盐溶液与Ba(OH)2溶液按溶质物质的量之比1:2混合反应,Al3+与OH-的物质的量比为1:4,则铝以AlO2-形式存在,反应的离子方程式为 Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O 。

 全优点练单元计划系列答案
全优点练单元计划系列答案 ,阴离子有
,阴离子有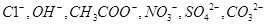 ,现将它们分别配成
,现将它们分别配成 的溶液,进行如下实验:
的溶液,进行如下实验:
 溶液,无明显现象;
溶液,无明显现象;