题目内容
【题目】往100 mL 1 mol·L -1 的AlCl3 溶液中滴加1 mol·L -1 的NaOH溶液,得3.9 g沉淀,则加入NaOH溶液的体积可能是
A. 100 mL B. 200 mL C. 300 mL D. 350 mL
【答案】D
【解析】氯化铝的物质的量是0.1mol,生成的氢氧化铝是3.9g÷78g/mol=0.05mol,如果氯化铝过量,则根据Al3++3OH-===Al(OH)3↓可知需要氢氧化钠是0.15mol,溶液体积是0.15mol÷1mol/L=0.15L=150mL;如果氢氧化钠过量,生成的氢氧化铝部分溶解,则0.1mol氯化铝需要0.3mol氢氧化钠生成0.1mol氢氧化铝,其中有0.05mol氢氧化铝溶解,根据Al(OH)3+OH-===AlO2-+2H2O可知又需要0.05mol氢氧化钠,则溶液体积是0.35mol÷1mol/L=0.35L=350mL,答案选D。
点睛:该题也可以借助图像解答,例如把强碱溶液逐滴加入到铝盐(Al3+)溶液中至过量的现象是:先有白色沉淀产生,然后沉淀逐渐溶解,有关反应:A→B:Al3++3OH-===Al(OH)3↓、B→D:Al(OH)3+OH-===AlO2-+2H2O,图像: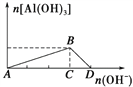 ,作纵坐标的垂线与图像有2个交点(B点除外),因此需要氢氧化钠的物质的量也有两种情况,解答时可以灵活应用。
,作纵坐标的垂线与图像有2个交点(B点除外),因此需要氢氧化钠的物质的量也有两种情况,解答时可以灵活应用。
【题型】单选题
【结束】
11
【题目】某溶液中有Fe3+、Mg2+ 、Fe2+ 和Al3+ 四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量增加的阳离子是
A. Fe3+ B. Mg2+ C. Fe2+ D. Al3+
【答案】A
【解析】Mg2+、Fe2+、Fe3+和Al3+四种阳离子中,若向其中加入过量的NaOH溶液,发生反应有:Mg2++2OH-=Mg(OH)2↓,Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3,Fe3++3OH-=Fe(OH)3↓,Al3++3OH-=Al(OH)3↓,再加入过量的盐酸,氢氧化镁、氢氧化铁、氢氧化铝溶解得到氯化镁、氯化铁与氯化铝,因此所得溶液中大量增加的阳离子是Fe3+,答案选A。

 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案【题目】下列各组物质中,X是主要物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的组合是 ( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
Y | FeCl3 | CuCl2 | Al | Na2CO3 |
Z | Cu | Fe | NaOH溶液 | BaCl2溶液 |
A. A B. B C. C D. D
【答案】C
【解析】A.铜粉与氯化铁反应生成氯化亚铁和氯化铜,会引入新杂质,故A错误;B.二者均与Fe反应,不符合除杂的原则,不能除杂,故B错误;C.Al与NaOH溶液反应,而Fe不能,则加NaOH溶解后过滤可除杂,故C正确;D.二者均与BaCl2溶液反应,应加适量硫酸除杂,故D错误;故选C。
【题型】单选题
【结束】
19
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
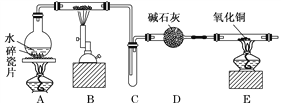
(1)A装置的作用是________________,B中反应的化学方程式为_____________。
(2)D的作用是____________________________________________________________。
(3)E中的现象是__________________________________________________________。
(4)A、B两个装置中应先点燃_______处的酒精灯,点燃E处酒精灯之前应进行的操作是_______________________________________________________________________。