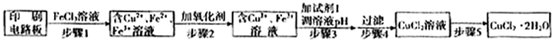题目内容
化学在生产、生活中有着广泛的应用.下列做法正确的是( )
分析:A.含有钾元素的肥料称为钾肥;
B.加工的明胶中铬含量严重超标;
C.工业废水经处理后可循环使用;
D.任意加入各种添加剂,过量是食品添加剂对人体有害,在达到预期的效果下尽可能降低在食品中的用量.
B.加工的明胶中铬含量严重超标;
C.工业废水经处理后可循环使用;
D.任意加入各种添加剂,过量是食品添加剂对人体有害,在达到预期的效果下尽可能降低在食品中的用量.
解答:解:A.农作物收获后,焚烧秸秆,产物固体为草木灰,草木灰中含有碳酸钾,碳酸钾属于钾肥,增加土壤中钾肥含量,但就地焚烧,焚烧后很多营养成分流失,同时导致土壤有机质损失,故A错误;
B.铬是重金属,回收制革工厂的边角皮料生产食用明胶中含铬,对人体的蛋白质产生变性作用,故B错误;
C.将工业废水“再生”处理,把废水变为较为纯净的水,可用于城市道路保洁、喷泉和浇花用水,故C正确;
D.食品添加剂,特别是化学合成的食品添加剂或多或少有一定的毒性,所以要严格控制使用量,如果尽可能多的使用各种色素、香味剂等添加剂,人使用后,对人体有害,故D错误;
故选C.
B.铬是重金属,回收制革工厂的边角皮料生产食用明胶中含铬,对人体的蛋白质产生变性作用,故B错误;
C.将工业废水“再生”处理,把废水变为较为纯净的水,可用于城市道路保洁、喷泉和浇花用水,故C正确;
D.食品添加剂,特别是化学合成的食品添加剂或多或少有一定的毒性,所以要严格控制使用量,如果尽可能多的使用各种色素、香味剂等添加剂,人使用后,对人体有害,故D错误;
故选C.
点评:本题主要考查了化学在生产、生活中常见的食品添加剂、秸秆焚烧问题、皮革中的重金属问题,难度不大,平时注意知识的积累.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
二氧化硫是硫的重要化合物,在生产、生活中有广泛应用.二氧化硫有毒,并且是形成酸雨的主要气体.无论是实验室制备还是工业生产,二氧化硫尾气吸收或烟气脱硫都非常重要.完成下列填空: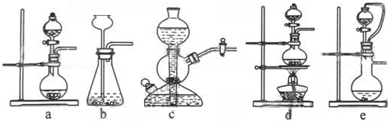
(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是 (填写字母).
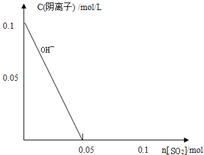
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠 g(保留一位小数);如果已有4.0%亚硫酸钠(质量分数),被氧化成硫酸钠,则至少需称取该亚硫酸钠 g(保留一位小数).
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4?2H2O.其流程如图:
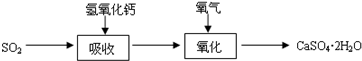
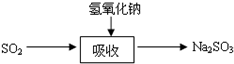
碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图:
已知:
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 .和碱法相比,石灰-石膏法的优点是 ,缺点是 .
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).

(1)实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫.
如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,图中可选用的发生装置是
(2)若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,至少需要称取亚硫酸钠
(3)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通.石灰-石膏法和碱法是常用的烟气脱硫法.石灰-石膏法的吸收反应为SO2+Ca(OH)2→CaSO3↓+H2O.吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O→2CaSO4?2H2O.其流程如图:

碱法的吸收反应为SO2+2NaOH→Na2SO3+H2O.碱法的特点是氢氧化钠碱性强、吸收快、效率高.其流程如图:

已知:
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(4)在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示).