题目内容
钠和钾是活泼的碱金属元素,钠和钾及其化合物在生产和生活中有广泛的应用.(1)将0.01mol下列物质①Na2O2②Na2O ③Na2CO3④NaCl分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为
(3)现有一Na2CO3和NaHCO3的混合物样品,取ag该混合物充分加热,减重bg,则该混合物样品中Na2CO3的质量分数是
(4)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊.若产生40.32L(标准状况下)氮气,至少需要叠氮化钠
(5)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.则该溶液中氢氧根离子的物质的量浓度是
(2)依据氧化还原反应电子守恒分析判断产物和配平化学方程式,燃料电池,燃料在负极失电子发生氧化反应;
(3)NaHCO3不稳定,加热易分解,根据质量的变化利用差值法解答;
(4)反应的方程式为2NaN3
| ||
(5)结合反应的方程式2Na+2H2O═2NaOH+H2↑、2K+2H2O═2KOH+H2↑计算.
故答案为:①=②>③>④;
(2)NH3与NaClO反应可得到肼(N2H4),氮元素化合价升高被氧化,次氯酸钠做氧化剂被还原为氯化钠,化学方程式为2NH3+NaClO=N2H4+NaCl+H2O,肼--空气燃料电池是一种碱性电池,该电池放电时,负极是肼燃烧生成氮气和水,负极的电极反应式为:N2H4-4e-+4OH-=N2+4H2O,
故答案为:2NH3+NaClO=N2H4+NaCl+H2O;N2H4+4OH--4e-=4H2O+N2;
(3)NaHCO3不稳定,加热易分解,发生2NaHCO3
| ||
则2NaHCO3
| ||
168g 106g 62g
x bg
x=
| 168b |
| 62 |
则样品中Na2CO3的质量为ag-
| 168b |
| 62 |
| 62a-168b |
| 62 |
所以该混合物样品中Na2CO3的质量分数是
| 62a-168b |
| 62a |
故答案为:
| 62a-168b |
| 62a |
(4)反应的方程式为2NaN3
| ||
2NaN3
| ||
130g 67.2L
m 40.32L
m=
| 130g×40.32L |
| 67.2L |
故答案为:78;
(5)设钠、钾的物质的量分别为a、b,反应的方程式为2Na+2H2O═2NaOH+H2↑、2K+2H2O═2KOH+H2↑,
则a+b=0.075mol×2=0.15mol,
该溶液中氢氧根离子的物质的量浓度是
| 0.15mol |
| 0.2L |
且23a+39b=5.05(质量守恒),
解之得a=0.050mol,b=0.10mol,n(Na):n(K)=1:2,该钠-钾合金化学式为NaK2,
故答案为:0.75(mol/L);NaK2.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案完成下列计算:
(1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊.若78克叠氮化钠完全分解,产生标准状况下氮气
(2)钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.计算溶液中氢氧化钠的物质的量浓度
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液.向该溶液中通入二氧化碳,有下列反应:2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O
己知通入二氧化碳112L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5.若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量的最大值.
(4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解).该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量.部分测定结果如下表:
| 铵盐的质量/g | 10.00 | 20.00 | 30.00 | 50.00 |
| 浓硫酸增加的质量/g | m | m | 1.29 | 0 |
该铵盐的成分为
该铵盐中氮元素的质量分数为:
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
57.叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠___g。
58.钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
(1)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
(2)计算并确定该钠-钾合金的化学式。
59.氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
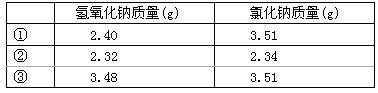
60.常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
|
| 氢氧化钠质量(g) | 氯化钠质量(g) |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击分解产生钠和氮气,故可应用于汽车安全气囊。若78克叠氮化钠完全分解,产生标准状况下氮气___________________L 。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。计算溶液中氢氧化钠的物质的量浓度______________________(忽略液体体积变化)。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应: 2NaAl(OH)4+CO2→2Al(OH)3↓+Na2CO3+H2O。己知通入二氧化碳112 L(标准状况下),生成的Al(OH)3和Na2CO3的物质的量之比为4:5。若向该溶液中通入的二氧化碳为224L(标准状况下),计算生成的 Al(OH)3和Na2CO3的物质的量的最大值。
(4)为测定某硫酸吸收含氨气废气后,所得铵盐中氮元素的质量分数,现将不同质量的铵盐固体分别加入到50.00mL相同浓度的氢氧化钠溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。部分测定结果如下表:
|
铵盐的质量/g |
10.00 |
20.00 |
30.00 |
50.00 |
|
浓硫酸增加的质量/g |
m |
m |
1.29 |
0 |
试回答:
该铵盐的成分为_______________________________。
该铵盐中氮元素的质量分数为:_______________________________(须列式计算)。