��Ŀ����
����β���ﺬ�е�NO������������ȼ��ȼ�յĸ�����������������Ӧ���£� N2(g)��O2(g)?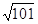 2NO(g)����H>0����֪�÷�Ӧ��2 404 �� ʱ��ƽ�ⳣ��K��64��10��4����ش�
2NO(g)����H>0����֪�÷�Ӧ��2 404 �� ʱ��ƽ�ⳣ��K��64��10��4����ش�
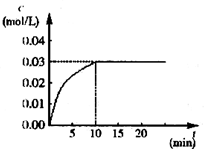
��1��ij�¶��£���2L���ܱ������г���N2��O2��1mol��5���Ӻ�O2�����ʵ���Ϊ0.5mol����N2�ķ�Ӧ����________��
��2���ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־________��
��3����N2��O2�Ļ�����������º����ܱ������У����б仯������ȷ����________(����ĸ���)��
��4������º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ��������NO���������______��(������С�����䡱)
��5�����¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10��1mol/L��4.0��10��2mol/L��3.0��10��3mol/L����ʱ��Ӧ___________(����ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С�)��������____
 2NO(g)����H>0����֪�÷�Ӧ��2 404 �� ʱ��ƽ�ⳣ��K��64��10��4����ش�
2NO(g)����H>0����֪�÷�Ӧ��2 404 �� ʱ��ƽ�ⳣ��K��64��10��4����ش���1��ij�¶��£���2L���ܱ������г���N2��O2��1mol��5���Ӻ�O2�����ʵ���Ϊ0.5mol����N2�ķ�Ӧ����________��
��2���ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־________��
| A������1 mol N2ͬʱ����1 mol O2 | B����������ܶȲ��� |
| C���������ƽ����Է����������� | D��2v(N2)����v(NO)�� |

��4������º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ��������NO���������______��(������С�����䡱)
��5�����¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10��1mol/L��4.0��10��2mol/L��3.0��10��3mol/L����ʱ��Ӧ___________(����ڻ�ѧƽ��״̬������������Ӧ������С������淴Ӧ������С�)��������____
��1��0.05 mol/(L��min)����2��A��D����3��A��C������4�����䣻��5�� ������Ӧ������С���ΪŨ����Qc<K
�����������1�� V(N2)=��C(N2)�¦�t="(0.5mol��2L)��5min=0.05" mol/(L��min)����2��A�����ݷ�Ӧ����ʽ��֪������1 mol N2ͬʱ������1 mol O2��������1 mol O2�����������������������������ȣ���Ӧ�ﵽƽ��״̬����ȷ��B����Ϊ��Ӧ���ں��������½��У���Ӧǰ�����������Ҳ���䣬�������۷�Ӧ�Ƿ�ﵽƽ�⣬��������ܶȲ��䣬��˲�����Ϊ�ж�ƽ��ı�־������C����Ϊ��������ʵ������䣬����Ҳ���䣬���Ի������ƽ����Է����������䲻����Ϊ�ж�ƽ��ı�־������D�����κ�ʱ�̶����ڣ� v(N2)���� (NO)��=1:2���� 2v(N2)����v(NO)������(NO)��= v(NO)������Ӧ�ﵽƽ��״̬����ȷ����3�����ڸ÷�Ӧ������Ӧ�����ȷ�Ӧ�����������¶ȣ���ѧƽ�������ƶ�����ѧƽ�ⳣ������A��ȷ�������������ѧ��Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ʱ�����̡����Ǵ�������ʹƽ�ⷢ���ƶ�����NO��ƽ��Ũ�Ȳ��䣬���Bѡ��������������¶ȣ�ƽ�������ƶ���������ת������ߡ���ѧ��Ӧ���ʼӿ죬�ﵽƽ������Ҫ��ʱ�����̣���C��ȷ����4������º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����ڸ÷�Ӧ�Ƿ�Ӧǰ�����������ȵķ�Ӧ��ѹǿ��Ӱ�����Ũ�ȵ�Ӱ�죬����һ����NO������ѹǿ����ѧƽ�ⲻ�����ƶ����������´ﵽ��ѧƽ��״̬����ԭƽ��״̬��ȣ���ʱƽ��������NO������������䡣��5�� (3.0��10��3)2��[(2.5��10��1)��( 4.0��10��2)]=9.0��10��4<64��10��4�����Է�Ӧ������Ӧ������С�

��ϰ��ϵ�д�
 ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�
�����Ŀ
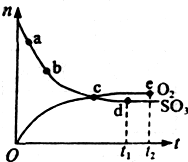
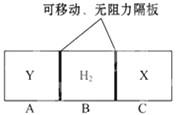
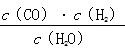 ����ش��������⡣
����ش��������⡣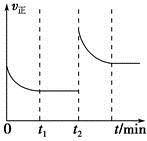
 CO(g)��3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CO(g)��3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��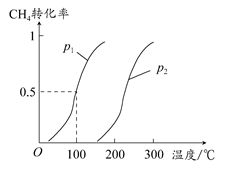
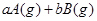

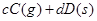
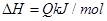 ����Ӧ�����У���������������ʱ��C�ڻ�����еĺ������¶ȣ�T���Ĺ�ϵ��ͼI��ʾ����Ӧ���ʣ�v����ѹǿ��p���Ĺ�ϵ��ͼII��ʾ����ͼ����������˵����ȷ���ǣ�������
����Ӧ�����У���������������ʱ��C�ڻ�����еĺ������¶ȣ�T���Ĺ�ϵ��ͼI��ʾ����Ӧ���ʣ�v����ѹǿ��p���Ĺ�ϵ��ͼII��ʾ����ͼ����������˵����ȷ���ǣ�������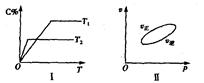
 CO2��g����H2��g�� ��H��0����Ӧ��CO2��Ũ����ʱ��仯�����ͼ��
CO2��g����H2��g�� ��H��0����Ӧ��CO2��Ũ����ʱ��仯�����ͼ��