题目内容
一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=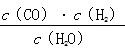 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
(3)该反应的v正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是________、________。
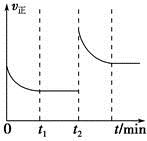
(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
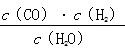 。请回答下列问题。
。请回答下列问题。(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
| A.v正(H2O)=v逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗n mol H2的同时消耗n mol CO |
| D.容器中物质的总物质的量不随时间改变 |

(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
(1)C(s)+H2O(g)  CO(g)+H2(g)(不写物质的状态也可) 吸热 (2)AB (3)升高温度 增大水蒸气的浓度 (4)0.004 mol·L-1·min-1
CO(g)+H2(g)(不写物质的状态也可) 吸热 (2)AB (3)升高温度 增大水蒸气的浓度 (4)0.004 mol·L-1·min-1
 CO(g)+H2(g)(不写物质的状态也可) 吸热 (2)AB (3)升高温度 增大水蒸气的浓度 (4)0.004 mol·L-1·min-1
CO(g)+H2(g)(不写物质的状态也可) 吸热 (2)AB (3)升高温度 增大水蒸气的浓度 (4)0.004 mol·L-1·min-1(1)根据平衡常数的定义可知CO和H2是生成物,根据元素守恒可知反应物还有C。温度升高,平衡常数增大,说明温度升高后平衡正向移动,因此该反应是吸热反应。(2)选项C在任何时刻都存在此关系,选项D无论平衡与否容器中的总物质的量都不发生变化,因此D也不能作为判断反应达平衡状态的依据。(3)把图像补全可知在t2时刻改变条件时,v正增大且平衡正向移动,因此可通过升温、增大水蒸气的浓度达到目的。(4)根据化学反应速率的定义计算。

练习册系列答案
相关题目
 2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
2NO(g) ΔH>0,已知该反应在2 404 ℃ 时,平衡常数K=64×10-4。请回答:
 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)
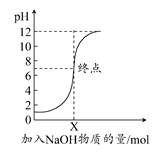
 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示: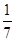
 2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是
2NH3(g) ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中不正确的是