题目内容
下列说法错误的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.200 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度: ④>①>②>③ |
B
解析试题分析:A、稀释醋酸,促进电离平衡向右移动,所以将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH小于4,正确;B、NaHA为酸式盐,无法根据溶液的酸碱性判断H2A是强酸还是弱酸,错误;C、因为CH3COONa水解显碱性,所以反应至中性时,溶液中的酸未被完全中和,正确;D、因为Ag+与Cl?浓度之积为常数,所以Cl?浓度越大,Ag+浓度越小,所以Ag+浓度: ④>①>②>③,正确。
考点:本题考查弱电解质的电离、弱酸的判断、酸碱中和反应、离子浓度比较。

练习册系列答案
相关题目
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中
逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中正确的是
| A.a点表示溶液中c(CH3COO-)约为10-3 mol/L |
| B.b点表示的溶液中c(Na+)>c(CH3COO-) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.d点表示的溶液中 大于K 大于K |
下列化学方程式中,属于水解反应的是
A.HCOOH+H2O HCOO-+H3O+ HCOO-+H3O+ | B.HS-+H2O S2-+H3O+ S2-+H3O+ |
C.CO2+H2O HCO3-+H+ HCO3-+H+ | D.CO32-+H2O HCO3-+OH- HCO3-+OH- |
已知温度T时,水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA溶液与b mol·L-1的一元碱BOH溶液等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)=  mol·L-1 mol·L-1 |
| D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
已知常温下浓度均为 0.l mol/L的下列三种溶液的PH:
下列有关说法中正确的是
| A.溶液中阳离子的物质的量浓度之和: Na2CO3 > NaCN > NaHCO3 |
| B.相同条件下的酸性: H2CO3 < HCN |
| C.三种溶液中均存在电离平衡和水解平衡 |
D.升高 Na2CO3溶液的温度, 减小 减小 |
25℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。下列说法正确的是
| A.曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
下列关于等物质的量浓度的Na2CO3溶液和NH4Cl溶液的叙述中正确的是
| A.Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+c(H2CO3) |
| B.NH4Cl溶液中:c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.c(CO32-)+c(HCO3-)+c(H2CO3)=c(NH4+)+c(NH3·H2O) |
| D.2c(CO32-)+c(HCO3-)-c(Na+)=c(Cl-)-c(NH4+) |
下列有关说法中正确的是( )
| A.常温下,将1 L pH=12的氨水加水稀释为10 L后溶液的pH=11 |
| B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V (乙)>10V(甲) |
C.向浓度均为0.1 mol·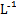 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] 的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2] |
| D.水的离子积常数KW随着温度的升高而增大,说明水的电离是放热反应 |