题目内容
【题目】【2015浙江卷】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定

取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
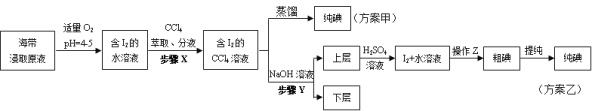
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一) 中的仪器名称:仪器A , 仪器 B 。
(2)①根据表中数据绘制滴定曲线:
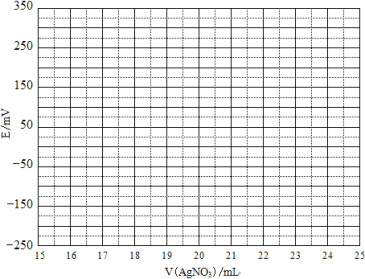
②该次滴定终点时用去AgNO3溶液的体积为 mL,计算得海带中碘的百分含量为 %。
(3)①分液漏斗使用前须检漏,检漏方法为 。
②步骤X中,萃取后分液漏斗内观察到的现象是 。
③下列有关步骤Y的说法,正确的是 。
A.应控制NaOH溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是 。
(4)方案甲中采用蒸馏不合理,理由是 。
【答案】(1)坩埚 500mL容量瓶 (2) ①  ② 20.00mL 0.635% (3)①向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水 ②液体分上下两层,下层呈紫红色 ③AB ④过滤 (4)主要由于碘易升华,会导致碘的损失
② 20.00mL 0.635% (3)①向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水 ②液体分上下两层,下层呈紫红色 ③AB ④过滤 (4)主要由于碘易升华,会导致碘的损失
【解析】(1)A、B两种仪器的名称分别为坩埚、500mL容量瓶(须注明容量瓶的容量)。
(2)①根据表中数据描出各点,然后连成光滑的曲线即可。
②从图像可知,有20.00mL附近滴定曲线发生突变,可判断滴定终点时用去AgNO3溶液的体积为20.00mL;根据关系式Ag+~I-可计算求得海带中碘的百分含量= 。
。
(3)①分液漏斗的检漏方法为:向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水。
②步骤X中,加入CCl4的作用是萃取碘水中的I2,萃取后I2溶解在CCl4中而呈紫色,由于CCl4的密度比水大,沉在下层,所以观察到的实验现象是:液体分上下两层,下层呈紫红色。
③步骤Y加入NaOH 的目的是把I2转化为离子(I-和IO3-)进入水层而与CCl4分离,并非浸取有机杂质,也不能用乙醇代替,但NaOH的用量要控制,用量过多会使后续酸化操作步骤消耗硫酸过多,故选AB。④Z步骤为过滤操作。
(4)I2的CCl4溶液采用蒸馏的方法虽然可以把CCl4蒸馏出去,但同时碘易升华,导致碘的损失。

 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案【题目】【山西省太原市2017届高三模拟考试(一)】利用如图所示装置进行下列实验,能得出相应实验结论的是( )
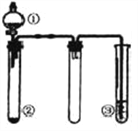
选项 | ① | ② | ③ | 实验结论 |
A | 稀盐酸 | CaCO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si |
B | 浓硫酸 | 蔗糖 | Ba(NO3)2溶液 | 验证SO2与可溶性钡盐可生成白色沉淀 |
C | 浓氨水 | 生石灰 | 酚酞溶液 | 氨气的水溶液呈碱性 |
D | 浓硝酸 | Fe | NaOH溶液 | 铁和浓硝酸反应可生成NO2 |