题目内容
19.下列有关化学用语表示正确的是( )| A. | CH4分子的球棍模型: | B. | 聚氯乙烯的结构简式为CH2CHCl | ||
| C. | 3,3-二甲基-1-戊烯的键线式: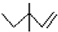 | D. | 乙醇分子的比例模型: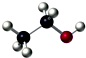 |
分析 A.该模型是比例模型;
B.聚氯乙烯为氯乙烯通过加聚反应生成的;
C.键线式中用短线表示化学键,端点、交点是C原子,C原子、H原子不需要标出,杂原子及杂原子上的H原子需要标出;
D.比例模型表示原子的比例大小关系、原子之间的连接顺序与空间结构.
解答 解:A. 为比例模型,甲烷分子的球棍模型为
为比例模型,甲烷分子的球棍模型为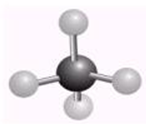 ,故A错误;
,故A错误;
B.聚乙烯通过加聚反应生成聚氯乙烯,聚氯乙烯正确的结构简式为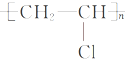 ,故B错误;
,故B错误;
C.键线式中用短线表示化学键,端点、交点是C原子,C原子、H原子不需要标出,3,3-二甲基-1-戊烯的键线式: ,故C正确;
,故C正确;
D. 表明乙醇分子中成键情况,是乙醇的球棍模型,乙醇分子的比例模型为:
表明乙醇分子中成键情况,是乙醇的球棍模型,乙醇分子的比例模型为: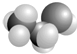 ,故D错误;
,故D错误;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及比例模型与球棍模型、结构简式、有机物命名等知识,明确常见化学用语的书写原则为解答关键.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
9.下列生活中的现象,不易造成危险的是( )
| A. | 庆典活动使用大量氢气球 | |
| B. | 打开长期密封的菜窖,并直接走下去 | |
| C. | 发现煤气大量泄漏后,立即打开脱排油烟机 | |
| D. | 用熟石灰来抹墙面 |
7.将50ml 0.5mol/L NaCl溶液加水稀释到250ml,稀释后溶液中NaCl的物质的量浓度为( )
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mol/L | D. | 0.4 mol/L |
4. 反应2NO2(g)?N2O4(g)△H=-57kJ/mol,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)△H=-57kJ/mol,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
 反应2NO2(g)?N2O4(g)△H=-57kJ/mol,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)△H=-57kJ/mol,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | a、c两点气体的颜色:a浅,c深 | |
| B. | a、c两点气体的平均相对分子质量:a>c | |
| C. | b、c两点的平衡常数:Kb=Kc | |
| D. | 状态a通过升高温度可变成状态b |
11.下列离子方程式不正确的是( )
| A. | Fe3O4与稀HNO3反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | 用稀H2SO4除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | 少量Ca(OH)2溶液与NaHCO3混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
8.下列说法正确的是( )
| A. | 常温下,0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合,测得混合溶液pH=8,则混合溶液中水电离产生的c(OH-)=1×10-8 | |
| B. | 室温下,CH3COONa和CaCl2的混合溶液:c (Na+)+c(Ca2+)=c (CH3COO-)+c(CH3COOH)+c(Cl-) | |
| C. | 恒容密闭容器中进行反应2A2(g)+B2(g)?2A2B(g)△H<0,达到化学平衡后,加热会使逆反应速率大于正反应速率 | |
| D. | 常温下,pH=11的氨水和pH=1的盐酸等体积混合,恰好完全反应,则混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=5×10-4mol/L |
9.在水中加入下列物质,可使水的电离平衡正向移动的是( )
| A. | NaCl | B. | Na2CO3 | C. | NH4Cl | D. | NaHSO4 |

 .
.