题目内容
4. 反应2NO2(g)?N2O4(g)△H=-57kJ/mol,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应2NO2(g)?N2O4(g)△H=-57kJ/mol,若保持气体总质量不变.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A. | a、c两点气体的颜色:a浅,c深 | |
| B. | a、c两点气体的平均相对分子质量:a>c | |
| C. | b、c两点的平衡常数:Kb=Kc | |
| D. | 状态a通过升高温度可变成状态b |
分析 A.二氧化氮为红棕色气体,a与c相比较,c点压强大;
B.结合M=$\frac{m}{n}$及n的变化分析;
C.b、c两点温度不同,该反应为放热反应;
D.放热反应,降低温度平衡正向移动,则二氧化氮的体积分数减小.
解答 解:A.二氧化氮为红棕色气体,a与c相比较,c点压强大,体积减小,二氧化氮浓度会变大,颜色深,则a、c两点气体的颜色:a浅,c深,故A正确;
B.气体总质量不变,a与c相比较,c点压强大,平衡正向移动,则n变小,由M=$\frac{m}{n}$可知,c点相对分子质量大,则a、c两点气体的平均相对分子质量:a<c,故B错误;
C.放热反应,降低温度平衡正向移动,则二氧化氮的体积分数减小,可知T1<T2,b、c两点温度不同,则b、c两点的平衡常数:Kb>Kc,故C错误;
D.放热反应,降低温度平衡正向移动,则二氧化氮的体积分数减小,由a→b体积分数减小,则应降低温度,故D错误;
故选A.
点评 本题考查化学平衡的图象,为高频考点,把握外界条件对化学平衡的影响及图象中纵横坐标的含义为解答的关键,注意结合“定一议二”、“先拐先平”解答该题,题目难度不大.

练习册系列答案
相关题目
15.下列化学实验操作中,不正确的是( )
| A. | 用灯帽盖灭酒精灯的火焰 | |
| B. | 稀释浓硫酸时,将浓硫酸缓缓加到水中,并不断用玻璃棒搅拌 | |
| C. | 将固体氢氧化钠直接放在托盘天平上称量 | |
| D. | 给试管里的固体加热,试管口应稍稍向下倾斜 |
12.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,11.2L 己烷含有的分子数为0.5NA | |
| B. | 1 mol 羟基(-OH)含有的电子数为10NA | |
| C. | 1 mol 氯气参加反应时,电子转移数目一定为2NA | |
| D. | 10 g H218O 含有的中子数为5NA |
19.下列有关化学用语表示正确的是( )
| A. | CH4分子的球棍模型: | B. | 聚氯乙烯的结构简式为CH2CHCl | ||
| C. | 3,3-二甲基-1-戊烯的键线式: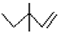 | D. | 乙醇分子的比例模型: |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 78g苯含有C=C双键的数目为3NA | |
| B. | 1L 0.1mol/L的NaClO溶液中含有ClO-的数目为0.1NA | |
| C. | 常温常压下,14g由N2和CO组成的混合气体含有的原子数为NA | |
| D. | 标准状况下,6.72L NO2与水反应转移电子数为0.1NA |
16.硼酸溶液中存在如下反应:H3BO3(aq)+H2O(l)?[B(OH)4]-(aq)+H+(aq),下列说法正确的是( )
| 化学式 | 电离常数(298K) |
| H3BO3 | K=5.7×10-10 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| CH3COOH | K=1.75×10-5 |
| A. | 等物质的量浓度的硼酸溶液和碳酸氢钠溶液比较,pH:后者>前者 | |
| B. | 等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者 | |
| C. | 将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生 | |
| D. | 将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生 |
14.下列叙述正确的是( )


| A. | A的结构简式是CH3CH2COOH | B. | B代表的是苯的结构模型 | ||
| C. | D代表的是甲烷 | D. | C和D互为同系物 |
 为检验Pb(NO3)2热分解的产物,有人用示意图中装置进行实验.(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y.(如图)
为检验Pb(NO3)2热分解的产物,有人用示意图中装置进行实验.(图中铁架台、铁夹和加热设备均略去)实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y.(如图)