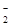题目内容
(12分)某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH 、Fe3+ 、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO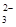 、AlO 、AlO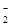 |
⑴探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如右图所示。
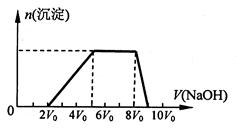
①该溶液中一定不存在的阳离子是______________ ,一定不存在的阴离子是__________;
含有的阳离子其对应物质的量浓度之比为__________________________________,
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
⑵探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 11.2 L | 22.4 L | 28.0 L |
| n (Cl-) | 2.5 mol | 3.5 mol | 4.0 mol |
| n (Br-) | 3.0 mol | 2.5mol | 2.0 mol |
| n (I-) | x mol | 0 | 0 |
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
(1)①Ag+、Mg2+、Fe3+ CO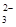 、AlO
、AlO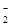 c(H+):c(NH
c(H+):c(NH ):c(Al3+) = 2:3:1
):c(Al3+) = 2:3:1
②Al(OH)3+OH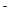 =AlO
=AlO +2H2O
+2H2O
(2) 2Cl2+6I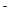 +2Br
+2Br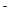 =3I2+4Cl
=3I2+4Cl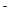 +Br2; 1:2:1
+Br2; 1:2:1
解析试题分析:(1)向混合液中滴加NaOH溶液,一开始无沉淀生成,说明含有H+;沉淀量最大时继续滴加NaOH溶液,不沉淀的量不变,说明含有NH4+,继续滴加,沉淀量减小直至消失,说明含有Al3+,一定不含有CO32-、AlO2-(均可与Al3+发生双水解反应),一定不含有Ag+、Mg2+、Fe3+(与OH-形成的沉淀不能溶于NaOH);由题目所给数据可得出H+、NH4+、Al3+的物质的量之比为:2:3:1;沉淀减少段发生的反应为:Al(OH)3+OH-=AlO2-+H2O
(2)当通入Cl2的体积为11.2L时,溶液中I-还有剩余,即氯气只与I-反应:Cl2+2I-=I2+2Cl-,生成1molCl-,Cl-初始物质的量是(2.5—1)mol="1.5" mol,Br-初始物质的量是3 mol;当通入Cl2的体积为22.4L时,部分溴离子(0.5mol)已被氧化:Cl2+2Br-=Br2+2Cl-,溴离子消耗氯气为 0.25 mol,故所有的I-共消耗Cl2:1-0.25=0.75mol,即原溶液中的I-是1.5 mol,则原溶液中Cl-、Br-、I-的物质的量浓度之比是1:2:1。
考点:离子的鉴别、氧化还原反应的计算
点评:本题综合性强,主要考查学生获取信息的能力,分析问题的能力和解决问题的能力。

 金钥匙试卷系列答案
金钥匙试卷系列答案某混合溶液中可能含有的离子如下表所示:
|
可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO |
为探究其成分,进行了以下探究实验。
(1)探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧 化钠溶液的体积(V)的关系如图所示。

①该溶液中一定含有的阳离子是______________,其对应物质的量浓度之比为________,一定不存在的阴离子是_____________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示, 分析后回答下列问题:
|
Cl2的体积(标准状况) |
5.6 L |
11.2 L |
22.4 L |
|
n (Cl-) |
2.5 mol |
3.0 mol |
4.0 mol |
|
n (Br-) |
3.0 mol |
2.8 mol |
1.8 mol |
|
n (I-) |
x mol |
0 |
0 |
①当通入Cl2的体积为5.6 L时,溶液中发生反应的离子方程式为_______________;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
(12分)某混合溶液中可能含有的离子如下表所示:
|
可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO |
为探究其成分,进行了以下探究实验。
⑴探究一:
甲同学取一定量的混合溶液,向其中逐滴加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如右图所示。

①该溶液中一定不存在的阳离子是______________ ,一定不存在的阴离子是__________;
含有的阳离子其对应物质的量浓度之比为__________________________________,
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
⑵探究二:
乙同学检测到该溶液中含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
|
Cl2的体积(标准状况) |
11.2 L |
22.4 L |
28.0 L |
|
n (Cl-) |
2.5 mol |
3.5 mol |
4.0 mol |
|
n (Br-) |
3.0 mol |
2.5mol |
2.0 mol |
|
n (I-) |
x mol |
0 |
0 |
①当起始至通入Cl2的体积为22.4L时,溶液中发生反应总的离子方程式为 __________________________________________ ;
②原溶液中Cl-、Br-、I-的物质的量浓度之比为______________________。
 、Fe3+
、Fe3+ 、AlO
、AlO
 、Fe3+
、Fe3+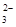 、AlO
、AlO