题目内容
【题目】表为周期表的一部分,其中的字母代表对应的元素,请针对这些元素回答下列问题. 
请回答下列问题:
(1)元素I的元素符号;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的周期族.
(2)表中元素第一电离能最小的是(填元素符号,下同),电负性最大的是 , 化学性质最稳定的是 .
(3)表中元素处于d区的是(填元素符号).
(4)请举出F的金属性比C强的实验事实: , 并用原子结构理论解释其原因:
【答案】
(1)Cr;四;VIB
(2)K;F;Ar
(3)Ti、Cr
(4)相同条件下,与水反应钾比钠剧烈(氢氧化钾的碱性比氢氧化钠强);钾的原子半径比钠大,原子核对最外层电子的吸引力较弱,比较容易失电子
【解析】解:由元素在周期表的位置可知,A~I分别为O、F、Na、Mg、Ar、K、Ca、Ti、Cr.
(1.)元素I为Cr,M2+离子3d轨道中有6个电子,M的价电子为3d64s2 , 则原子序数为18+2+6=26,为Fe元素,位于周期表的四周期VIB族,所以答案是:Cr;四;VIB;
(2.)K的金属性最强,第一电离能最小;F的非金属性越强,电负性越大;稀有气体的性质最稳定,则Ar的化学性质最稳定,所以答案是:K;F;Ar;
(3.)最后填充的d电子位于d区,可知元素处于d区的是Ti、Cr,所以答案是:Ti、Cr;
(4.)F的金属性比C强,相同条件下,与水反应钾比钠剧烈(氢氧化钾的碱性比氢氧化钠强),用原子结构理论解释其原因为钾的原子半径比钠大,原子核对最外层电子的吸引力较弱,比较容易失电子,所以答案是:相同条件下,与水反应钾比钠剧烈(氢氧化钾的碱性比氢氧化钠强);钾的原子半径比钠大,原子核对最外层电子的吸引力较弱,比较容易失电子.

【题目】用下列装置(尾气处理已略去)进行相关实验,能实现实验目的的是

实验目的 | a中试剂 | b中试剂 | c中试剂 | |
A | 比较 | 醋酸溶液 | 碳酸钠 | 硅酸钠溶液 |
B | 比较 | 浓盐酸 | 高锰酸钾 | 碘化钾溶液 |
C | 证明苯和液溴发生取代反应 | 苯和液溴 | 铁粉 | 硝酸银溶液 |
D | 证明 | 饱和食盐水 | 电石 | 酸性高锰酸钾溶液 |
A. A B. B C. C D. D
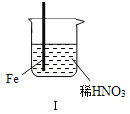
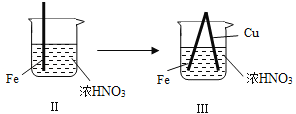
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
下列说法正确的是( )
A. T2时,NO2的平衡转化率为70.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80molH2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小