题目内容
【题目】如图是Zn和Cu形成的原电池,回答下列问题:
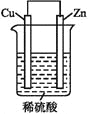
(1)正极发生____反应(选填“氧化”或“还原”),负极电极反应式为:____。
(2)电子流动方向,从____电极(选填“Cu”或“Zn”),经外电路,流向另一电极。阳离子向____电极定向移动(选填“Cu”或“Zn”)。
(3)有0.1 mol电子流过导线,则产生H2在标准状况下的体积为____,若是断开Zn和Cu之间的导线,产生气泡的速度____(选填“加快”、“不变”或“减慢”)。
【答案】(1)还原;Zn-2e-=Zn2+;(2)Zn;Cu;(3)1.12 L;减慢。
【解析】试题分析:(1)根据原电池的构成条件,Zn作负极,Cu作正极,根据原电池的工作原理,正极电极反应式为2H++2e-=H2↑,得到电子被还原,发生还原反应,负极电极反应式为:Zn-2e-=Zn2+;(2)根据原电池的工作原理,电子从负极经外电路流向正极,阳离子从负极流向正极,负极为锌,正极为铜,因此电子:锌→外电路→铜,阳离子从锌流向铜;(3)2H++2e-=H2↑,通过0.1mol电子产生V(H2)=0.1×22.4/2L=1.12L,原电池加快反应速率,断开导线,不在是原电池,则化学反应速率减缓。

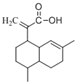
【题目】有机物M可从酸牛奶中提取。已知纯净的M为无色黏稠液体, 易溶于水。为研究M的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取M4.5 g,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空:(1)M的摩尔质量为: __ 。 |
(2)将此4.5 g M 在足量纯 O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6 g | (2)M的分子式为:____ 。 |
(3)通过M 的红外光谱图发现该分子中既有 羟基,还有羧基 | (3)写出M中含有的官能团羟基电子式:__ |
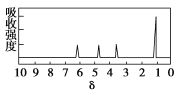
(4)M 的核磁共振氢谱如下图:
| (4)M 中含有___种氢原子。 |
(5)综上所述,M 的结构简式为_____ 。 | |