题目内容
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子的最外层电子数与次外电子数之比为3∶4;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,据此回答:
①N的最高价氧化物的水化物的化学式是 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,A溶液中水的电离程度最小,则化合物A中的化学键类型为 ,若B为常见家用消毒剂的主要成分,则B的化学式是 。
③Z与M形成的稳定固体化合物的电子式为 。
④X与Y、X与M均可形成18电子分子,写出这两种分子在水溶液中反应生成一种可观察到的实验现象是 。
①HClO4
②离子键、(极性)共价键
NaClO
③Na+ ![]() Na+
Na+
④H2O2+H2S=====S↓+2H2O
无色溶液中产生淡黄色浑浊

练习册系列答案
相关题目
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法中不正确的是( )
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |



 如图为元素周期表短周期的一部分,有关元素X、Y、Z、M的说法不正确的是( )
如图为元素周期表短周期的一部分,有关元素X、Y、Z、M的说法不正确的是( )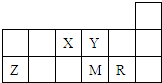 短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法正确的是( )