题目内容
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y元素原子最外层电子数与核外电子总数之比为3:4,M元素原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;N-、Z+、X+的半径逐渐减小;化合物XN在常温下为气体,据此回答下列问题:
(1)写出Z与N形成的化合物的化学式
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式
(3)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:

(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1:1:1.若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为
(1)写出Z与N形成的化合物的化学式
NaCl
NaCl
.(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
(分解反应).
| ||
(3)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:
2SO2+O2
2SO3
| ||
| △ |
2SO2+O2
2SO3
.
| ||
| △ |

(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1:1:1.若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为
NaOH
NaOH
,B的化学式为NaClO或NaHS
NaClO或NaHS
.分析:元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.Y元素原子最外层电子数与核外电子总数之比为3:4,最外层电子数只能为6,则原子总数为8,Y为O元素;M原子的质子数是Y原子的2倍,则M为S元素;结合N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,可判N为Cl元素,Z为Na元素,X为氢元素,据此回答下列问题.
解答:解:元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.Y元素原子最外层电子数与核外电子总数之比为3:4,最外层电子数只能为6,则原子总数为8,Y为O元素;M原子的质子数是Y原子的2倍,则M为S元素;结合N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,可判N为Cl元素,Z为Na元素,X为氢元素,
(1)Z与N形成的化合物的化学式为NaCl,故答案为:NaCl;
(2)H与O可分别形成10电子和18电子的分子,分别为H2O、H2O2,H2O2在二氧化锰作催化剂条件下分解生成水与氧气,反应方程式为:2H2O2
2H2O+O2↑,
故答案为:2H2O2
2H2O+O2↑;
(3)由图可知,该转化过程为SO2与O2反应生成三氧化硫,反应化学方程式为:2SO2+O2
2SO3,
故答案为:2SO2+O2
2SO3;
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1:1:1.若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,结合元素可知,A为NaOH,B为NaClO或NaHS,
故答案为:NaOH;NaClO或NaHS.
(1)Z与N形成的化合物的化学式为NaCl,故答案为:NaCl;
(2)H与O可分别形成10电子和18电子的分子,分别为H2O、H2O2,H2O2在二氧化锰作催化剂条件下分解生成水与氧气,反应方程式为:2H2O2
| ||
故答案为:2H2O2
| ||
(3)由图可知,该转化过程为SO2与O2反应生成三氧化硫,反应化学方程式为:2SO2+O2
| ||
| △ |
故答案为:2SO2+O2
| ||
| △ |
(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1:1:1.若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,结合元素可知,A为NaOH,B为NaClO或NaHS,
故答案为:NaOH;NaClO或NaHS.
点评:本题考查结构物质性质关系应用,难度不大,根据核外电子排布规律推断元素是解题关键,侧重对基础知识的巩固.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法中不正确的是( )
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |


 如图为元素周期表短周期的一部分,有关元素X、Y、Z、M的说法不正确的是( )
如图为元素周期表短周期的一部分,有关元素X、Y、Z、M的说法不正确的是( )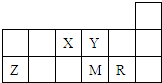 短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法正确的是( )
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法正确的是( )