题目内容
6g某单质X能从盐酸中置换出0.3g H2,同时生成XCl2;另一种元素Y,它的最高价氧化物的化学式为YO3,在Y的氢化物中,Y的质量分数为94.1%。
(1)X、Y两元素的相对原子质量:X ;Y 。
(2)写出Y的另一种常见氧化物与足量X的最高价氧化物对应水化物反应的化学方程式 。
(1)X、Y两元素的相对原子质量:X ;Y 。
(2)写出Y的另一种常见氧化物与足量X的最高价氧化物对应水化物反应的化学方程式 。
(6分)(1)X Ca ;Y S (2)SO2+Ca(OH)2=CaSO3+H2O
试题分析:(1)6g某单质X能从盐酸中置换出0.3g H2,同时生成XCl2
这说明6gX在反应中失去

又因为X的化合价是+2价,失去2个电子
所以X的物质的量是0.15mol
则X的相对分子质量是
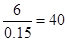
所以X是Ca元素
Y的最高价氧化物的化学式为YO3
则Y的最高价是+6价,则最低价是-2价
所以根据在Y的氢化物中,Y的质量分数为94.1%可知
Y的相对原子质量是
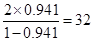
即Y是S元素。
(2)SO2是酸性氧化物,和氢氧化钙反应的化学方程式是SO2+Ca(OH)2=CaSO3+H2O。
点评:该题是中等难度试题的考查,侧重对学生基础知识的巩固和训练,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和创新思维能力。该题的关键是利用好元素周期律,然后结合题意灵活运用即可。

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
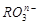 共有
共有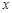 个核外电子,R的质量数为A,R的中子数是
个核外电子,R的质量数为A,R的中子数是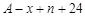
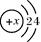
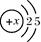


 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0  Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)
Si(s)+4HCl(g);△H=+QkJ·mol-1(Q>0)