题目内容
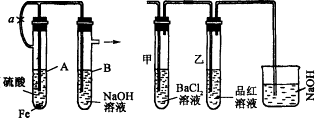
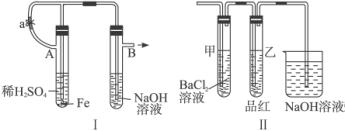
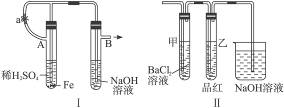
根据下述实验装置和操作,回答有关问题:按图6-27中所示装置,用两种不同操作分别进行实验,观察B管中的现象。

图6-27
操作Ⅰ:先夹紧止水夹a,再使A管开始反应。实验中在B管中观察到的现象是_____________。B管中发生的反应的离子方程式是:___________________________。
操作2:打开止水夹a,使A管开始反应一段时间后再夹紧止水夹a,实验中在B管中观察到的现象是_________________。B管中发生的反应的离子方程式是_________________。
解析:此题是围绕Fe(OH)2的实验室制法设计的。由于Fe(OH)2极易被氧化为Fe(OH)3,溶液中溶解的氧气就能把它氧化。当夹紧a时,A试管便成了一个封闭体系,产生的氢气使A试管内压强增大,将生成的FeSO4溶液压入B中。从而发生反应,有Fe(OH)2生成,而在NaOH溶液中溶解的氧气可将Fe(OH)2迅速氧化,最后转变成Fe(OH)3,所以看到白色沉淀的时间很短。
当用操作2时,产生的H2首先通过导气管通入到B中的NaOH溶液中,将其中溶解的O2赶走,再夹紧a时,FeSO4溶液压入B中,此时反应所产生的Fe(OH)2在一段时间内不变色。
答案:操作1:先出现白色絮状沉淀,然后沉淀迅速变成灰绿色,最后变成红褐色
Fe2++2OH-====Fe(OH)2↓
4Fe(OH)2+O2+2H2O====4Fe(OH)3
操作2:打开止水夹时,溶液中的导管口有气泡冒出,夹紧夹子后出现白色絮状沉淀。一段时间内沉淀不变色 Fe2++2OH-====Fe(OH)2↓

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目