题目内容
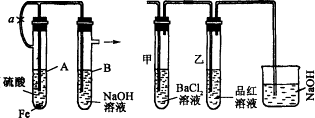
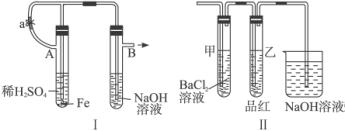
根据下述实验装置和操作,回答有关问题:
(1)按图Ⅰ中所示装置,用两种不同操作分别进行实验,观察B管中现象。
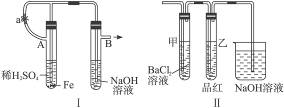
操作1:先夹紧止水夹a,再使A管开始反应,实验中在B管中观察到的现象是______________
______________________________________________________________________________。
B管中发生反应的离子方程式是___________________________________________________。
操作2:打开止水夹a,使A管开始反应一段时间后再夹紧止水夹a,实验中在B管中观察到的现象是_____________________________________________________________________。
(2)上述装置的实验结束后,取A管内反应所得溶液,隔绝空气小心蒸干后,再高温煅烧(有关装置及操作已略去),最后留下红色固体。将分解时产生的气体按图Ⅱ所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内溶液红色褪色,回答:
①用化学方程式说明试管甲产生白色沉淀的原因(不用文字说明)____________________。
②根据实验现象,写出图Ⅰ中A管内溶液蒸干后,在高温下煅烧分解时所发生的氧化还原反应的化学方程式________________________________________________________________。
这个反应的氧化剂是_______________________,还原剂是____________________________。
(1)操作1:先出现白色絮状沉淀,然后沉淀迅速变灰绿色,最后变为红褐色
Fe2++2OH-====Fe(OH)2↓ 4Fe(OH)2+O2+2H2O====4Fe(OH)3
操作2:打开止水夹时,溶液中的导管口有气泡冒出,夹紧夹子后,出现白色絮状沉淀,一段时间内沉淀不变色
(2)①SO3+BaCl2+H2O====BaSO4↓+2HCl
②2FeSO4![]() Fe2O3+SO2↑+SO3↑ FeSO4 FeSO4
Fe2O3+SO2↑+SO3↑ FeSO4 FeSO4
解析:
此题涉及点较多,既考查学生的实验能力,又考查思维的严密性、整体性和创造性。此题第一部分是围绕Fe(OH)2的实验室制法设计的。由于Fe(OH)2极易被氧化为?Fe(OH)3,溶液中溶解的O2就能把Fe(OH)2氧化。当夹紧a时,A试管便成了一个封闭体系,产生的H2使A试管内压强增大,将生成的FeSO4溶液压入B中,从而发生反应,有?Fe(OH)2生成。而NaOH溶液中溶解的O2可将Fe(OH)2迅速氧化,最后转化成Fe(OH)3,所以,看到白色沉淀的时间很短。当进行操作2时,产生的H2首先通过导气管通入到B的NaOH溶液中,将其中溶解的O2赶走,再夹紧a时,FeSO4溶液压入B中,此时反应所产生的Fe(OH)2沉淀在一段时间内不变色;此题第二部分围绕FeSO4隔绝空气强热时的产物逆向推理,并利用已学过的氧化还原知识推断出FeSO4高温分解反应的化学方程式。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案