题目内容
11.关于Na2CO3和NaHCO3的说法正确的是( )| A. | 它们的物质的量相等时,跟足量的盐酸反应,在相同状况时放出的CO2体积相同 | |
| B. | 它们的物质的量相等时,跟足量的盐酸反应,所消耗盐酸的物质的量相同 | |
| C. | 它们的物质的量相等时,在水中电离出相同数目的Na | |
| D. | 它们的物质的量相等时,与足量盐酸反应产生物质的量相等的CO2 |
分析 A、根据C元素守恒判断;
B、物质的量相等时,与足量的稀盐酸反应,所消耗HCl的物质的量不同;
C、钠元素守恒,它们的物质的量相等时,Na2CO3和NaHCO3在水中电离出的Na离子不同;
D、碳元素守恒,它们的物质的量相等时,与足量盐酸反应产生物质的量相等的CO2.
解答 A、它们的物质的量相等时,跟足量的盐酸反应,反应后都生成二氧化碳,根据C元素守恒可知,生成二氧化碳体积相同,故A正确;
B、根据Na元素守恒,与盐酸反应后都生成NaCl,则碳酸钠消耗的盐酸多,故B错误;
C、Na2CO3=Na++CO32-,NaHCO3=Na++HCO3-,它们的物质的量相等时,在水中电离出的Na离子数不同,故C错误;
D、反应后都生成二氧化碳,根据C元素守恒可知,生成二氧化碳体积相同,故D正确;
故选AD.
点评 本题考查碳酸钠和碳酸氢钠的性质,题目难度不大,注意从守恒的角度分析,掌握基础是关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列不能表明醋酸是弱电解质的是( )
| A. | 0.1mol/L的醋酸水溶液中,c(H+)约为10-3mol/L | |
| B. | 常温下同浓度醋酸水溶液的导电性比盐酸弱 | |
| C. | 醋酸水溶液能使紫色石蕊试液变红 | |
| D. | 醋酸稀溶液中同时存在CH3COOH和CH3COO- |
2.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4L H2O含有的分子数为NA | |
| B. | 一定条件下,56克铁粉与足量的HCl溶液完全反应,转移电子数为3NA | |
| C. | 标准状况下,22.4L氦气中所含原子数为NA | |
| D. | 1 mol•L-1 NaCl溶液中所含有的Na+离子数目为NA |
19.标准状况下,与16gO2所占体积大致相等的是( )
| A. | 0.5molH2O | B. | 5.6L甲烷 | C. | 3.01×1023个N2 | D. | 44gCO2 |
6.已知:4NH3+5O2$\frac{\underline{\;\;\;高温\;\;\;}}{催化剂}$4NO+6H2O,若反应速率用v表示,以下关系正确的是( )
| A. | $\frac{4}{5}$v (NH3)=v (O2) | B. | $\frac{5}{6}$v (O2)=v (H2O) | C. | $\frac{3}{2}$v (NH3)=v (H2O) | D. | $\frac{5}{4}$v (O2)=v (NO) |
16.在无色透明溶液中,能大量共存的离子组是( )
| A. | K+ Cu2+ Na+ SO42- | B. | Mg2+ Cl- OH- SO42- | ||
| C. | K+ H+ NO3- CO32- | D. | Na+ Cl- NO3-CO32- |
20.以下各组微粒互为同位素的是( )
| A. | O2与O3 | B. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U | ||
| C. | ${\;}_1^2$H2与H2 | D. | ${\;}_1^2$H2O与H2O |
20.下列反应的离子方程式书写正确的是( )
| A. | 向饱和碳酸氢钙溶液中加入过量氢氧化钙溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-=AlO2-+H2↑ | |
| C. | 用氢氧化钠溶液吸收二氧化碳:2OH-+CO2=CO32-+H2O | |
| D. | Mg(HCO3)2 溶液 与过量 NaOH 溶液反应:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O |
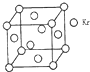 测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=3(填数字).
测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线放射源可用85Kr.已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=3(填数字).