题目内容
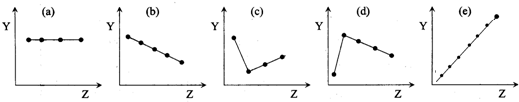
Ⅰ、下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质);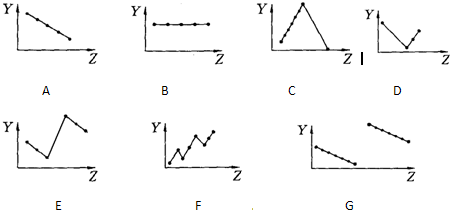
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数
(3)IA族碱金属元素单质熔点
(4)第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径
(5)第二、三周期元素随原子序数递增原子半径的变化
Ⅱ、在①126C ②3919K ③4020Ca ④136C ⑤147N ⑥4018Ar中:(用序号填空)
(1)互为同位素的是
(2)质量数相等,但不能互称同位素的是
(3)中子数相等,但质子数不相等的是

把与下面的元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素的价电子数
B
B
(2)第三周期元素的最高化合价C
C
(3)IA族碱金属元素单质熔点
A
A
(4)第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径
E
E
(5)第二、三周期元素随原子序数递增原子半径的变化
G
G
Ⅱ、在①126C ②3919K ③4020Ca ④136C ⑤147N ⑥4018Ar中:(用序号填空)
(1)互为同位素的是
①
①
和④
④
;(2)质量数相等,但不能互称同位素的是
③
③
和⑥
⑥
;(3)中子数相等,但质子数不相等的是
④
④
和⑤
⑤
,②
②
和③
③
.分析:Ⅰ、(1)ⅡA族元素的价电子数为2,随核电荷数增大,价电子数不变.
(2)第三周期元素的最高化合价,随核电荷数增大,最高化合价由+1价递增到+7,最后以稀有气体0价结束.
(3)碱金属,随核电荷数增大,金属键减弱,碱金属熔点降低.
(4)电子层结构相同,核电荷数越大,离子半径越小,最外层电子数相同,电子层越多,离子半径越大.
(5)同周期主族元素,随原子序数递增原子半径减小.
Ⅱ、(1)质子数相同中子数不同的同一元素不同原子互为同位素.
(2)质量数相等,但不能互称同位素,应是不同元素.
(3)根据质量数=质子数+中子数计算各微粒的中子数,结合微粒ZAX判断.
(2)第三周期元素的最高化合价,随核电荷数增大,最高化合价由+1价递增到+7,最后以稀有气体0价结束.
(3)碱金属,随核电荷数增大,金属键减弱,碱金属熔点降低.
(4)电子层结构相同,核电荷数越大,离子半径越小,最外层电子数相同,电子层越多,离子半径越大.
(5)同周期主族元素,随原子序数递增原子半径减小.
Ⅱ、(1)质子数相同中子数不同的同一元素不同原子互为同位素.
(2)质量数相等,但不能互称同位素,应是不同元素.
(3)根据质量数=质子数+中子数计算各微粒的中子数,结合微粒ZAX判断.
解答:解:Ⅰ、(1)ⅡA族元素的价电子数为2,随核电荷数增大,价电子数不变,故图B符合.
故选:B.
(2)第三周期元素的最高化合价,随核电荷数增大,最高化合价由+1价递增到+7,最后以稀有气体0价结束,故图C符合.
故选:C.
(3)碱金属,随核电荷数增大,金属键减弱,碱金属熔点降低,故图A符合.
故选:A.
(4)电子层结构相同,核电荷数越大,离子半径越小,所以离子半径Na+>Mg2+>Al3+、P3->S2->Cl-,最外层电子数相同,电子层越多,离子半径越大,所以离子半径Cl->Na+.所以离子半径P3->S2->Cl->Na+>Mg2+>Al3+,故图E符合.
故选:E.
(5)同周期主族元素,随原子序数递增原子半径减小,故图G符合.
故选:G.
Ⅱ、(1)质子数相同中子数不同的同一元素不同原子互为同位素,①126C 和④136C 质子数相同为6,中子数不同,分别为6、7,为碳元素的同位素.
故选:①和④.
(2)③4020Ca和⑥4018Ar质量数相等为40,是不同元素,不能互称同位素.
故选:③和⑥.
①126C ②3919K ③4020Ca ④136C ⑤147N ⑥4018Ar中
(3)④136质子数为6,中子数为13-6=7,⑤147N质子数为7,中子数为14-7=7,二者中子数相等,但质子数不相等.
②3919K质子数为19,中子数为39-19=20,③4020Ca质子数为20,中子数为40-20=20,二者中子数相等,但质子数不相等.
故选:④和⑤;②和③.
故选:B.
(2)第三周期元素的最高化合价,随核电荷数增大,最高化合价由+1价递增到+7,最后以稀有气体0价结束,故图C符合.
故选:C.
(3)碱金属,随核电荷数增大,金属键减弱,碱金属熔点降低,故图A符合.
故选:A.
(4)电子层结构相同,核电荷数越大,离子半径越小,所以离子半径Na+>Mg2+>Al3+、P3->S2->Cl-,最外层电子数相同,电子层越多,离子半径越大,所以离子半径Cl->Na+.所以离子半径P3->S2->Cl->Na+>Mg2+>Al3+,故图E符合.
故选:E.
(5)同周期主族元素,随原子序数递增原子半径减小,故图G符合.
故选:G.
Ⅱ、(1)质子数相同中子数不同的同一元素不同原子互为同位素,①126C 和④136C 质子数相同为6,中子数不同,分别为6、7,为碳元素的同位素.
故选:①和④.
(2)③4020Ca和⑥4018Ar质量数相等为40,是不同元素,不能互称同位素.
故选:③和⑥.
①126C ②3919K ③4020Ca ④136C ⑤147N ⑥4018Ar中
(3)④136质子数为6,中子数为13-6=7,⑤147N质子数为7,中子数为14-7=7,二者中子数相等,但质子数不相等.
②3919K质子数为19,中子数为39-19=20,③4020Ca质子数为20,中子数为40-20=20,二者中子数相等,但质子数不相等.
故选:④和⑤;②和③.
点评:考查元素周期律、结构与性质递变规律、同位素等,难度不大,注意规律的归纳与总结与理解.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目