题目内容
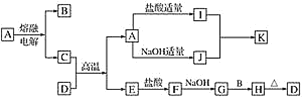
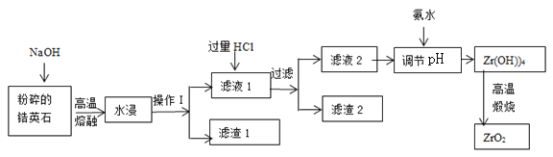
【题目】氧化锆(ZrO2)材料具有高硬度、高熔点、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有________________________________。
(2)操作I的名称是__________________,滤渣1成分为_________,滤渣2的成分为_____________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:____________________。
(4)“调节pH”时,合适的pH范围是__________________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是__________________。
(5)写出“高温煅烧”过程的化学方程式________________________________。根据ZrO2的性质,推测其一种用途________________________________。
【答案】粉碎、高温 过滤 Fe2O3 H2SiO3 4NaOH+ZrSiO4![]() Na2ZrO3+Na2SiO3+2H2O 3.2~3.4 取最后一次洗涤液加入硝酸银溶液和稀硝酸,没有白色沉淀证明洗涤干净 Zr(OH)4
Na2ZrO3+Na2SiO3+2H2O 3.2~3.4 取最后一次洗涤液加入硝酸银溶液和稀硝酸,没有白色沉淀证明洗涤干净 Zr(OH)4![]() ZrO2+2H2O 耐火材料、坩埚、打磨材料牙齿材料等
ZrO2+2H2O 耐火材料、坩埚、打磨材料牙齿材料等
【解析】
锆英砂(主要成分为ZrSiO4,还含少量Fe2O3、Al2O3、SiO2等杂质)加NaOH熔融,二氧化硅反应转化为硅酸钠,ZrSiO4转化为Na2SiO3和Na2ZrO3,氧化铝和氢氧化钠反应生成偏铝酸钠,水浸过滤,滤渣1为Fe2O3,得到滤液1中加过量盐酸酸浸,Na2SiO3与HCl生成硅酸沉淀,偏铝酸钠和过量盐酸反应得到氯化铝,滤渣2为H2SiO3,滤液中含有ZrO2+、Al3+,加氨水调节pH为3.2~3.4使ZrO2+转化为Zr(OH)4沉淀,过滤、洗涤,得到Zr(OH)4,加热分解,即可得到ZrO2。
(1)流程中旨在提高化学反应速率的措施有粉碎固体,升高温度。
(2)操作Ⅰ用于分离固体和液体,操作I的名称是过滤,滤渣1成分为Fe2O3,滤渣2的成分为H2SiO3。
(3)锆英石经“高温熔融”转化为Na2ZrO3,高温下,ZrSiO4与NaOH反应生成Na2SiO3和Na2ZrO3,该反应的化学方程式:4NaOH+ZrSiO4![]() Na2ZrO3+Na2SiO3+2H2O。
Na2ZrO3+Na2SiO3+2H2O。
(4)“调节pH”时,合适的pH范围是3.2~3.4使ZrO2+完全转化为Zr(OH)4沉淀,且避免生成Al(OH)3;Zr(OH)4表面为附着Cl-等,为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是:取最后一次洗涤液,向其中滴加稀硝酸,再滴加硝酸银溶液,若无沉淀生成,则Zr(OH)4洗涤干净。
(5)“高温煅烧”过程的化学方程式Zr(OH)4![]() ZrO2+2H2O。根据ZrO2的性质,推测其一种用途,推测其两种用途有耐火材料、磨料等。
ZrO2+2H2O。根据ZrO2的性质,推测其一种用途,推测其两种用途有耐火材料、磨料等。

 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案